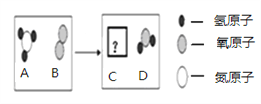
题目内容
【题目】水是生命之源,也是人类宝贵的资源,所以我们应该了解水的有关知识。
(1)下列水是纯净物的是_________(填序号)
A.饮用水 B.蒸馏水 C.自来水
(2)有些村民用地下水作为饮用水,人们常用___________检验地下水是硬水还是软水,生活中常用___________降低水的硬度,该方法的原理之一是水中溶有碳酸氢钙[Ca(HCO3)],在加热条件下,可生成碳酸钙、水、二氧化碳,其反应的化学方程式为____________;
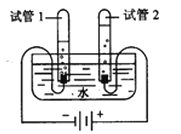
(3)如图是电解水的实验,试管1中收集到的气体是___________,反应的方程式为:__________________。
【答案】 B 肥皂水 煮沸 Ca(HCO3)2 ![]() CaCO3↓+H2O+CO2↑ 氢气 2H2O
CaCO3↓+H2O+CO2↑ 氢气 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】(1)A.饮用水属于混合物,错误;B.蒸馏水属于纯净物,正确;C.自来水属于混合物,错误。故选B。(2)检验软水硬水用肥皂水。生活中常用煮沸的方法降低水的硬度,根据信息,反应的化学方程式为Ca(HCO3)2 ![]() CaCO3↓+H2O+CO2↑(3)电解水时正氧负氢,反应的方程式为2H2O
CaCO3↓+H2O+CO2↑(3)电解水时正氧负氢,反应的方程式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑

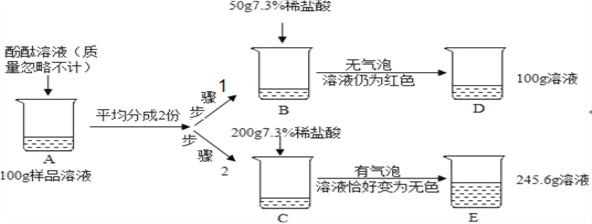
【题目】以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图。
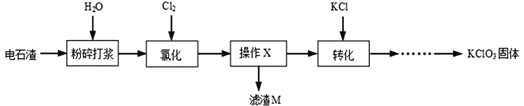
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6 Ca(OH)2 + 6 Cl2 = Ca(ClO3)2 + 5CaCl2 + aH2O
(1)氯化前,先将电石渣粉碎的目的是___________。
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为_______________价,a数值为___________。
(3)操作X为______________。转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为_____________。(相关物质的溶解度见下图)
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③___________。
【实验验证】
实验步骤 | 实验现象 | 结论 |
步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入_______; | 观察到___________现象 | 猜想①不正确 |
步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到___________现象 | 猜想③正确 |