题目内容
【题目】下表为元素周期表中部分元素的相关信息,请利用下表回答相关问题。
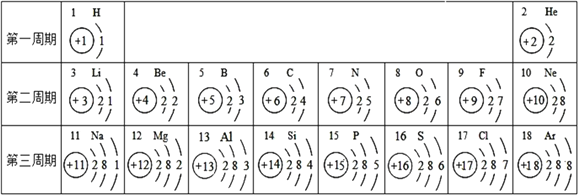
(1)碳原子核电荷数是__________。
(2)12号元素的原子在化学反应中比较容易____________(填“得到”或“失去”)电子,该元素属于__________(填“金属”或“非金属”)元素。
(3)在同一周期中,从左到右各元素的原子最外层电子数逐渐________________。
(4)将2.4gCH4与8.0g由8号元素组成的单质,在点燃条件下恰好完全反应,生成5.4gH2O、2.2gCO2和物质X。物质X的化学式为_________,该化学方程式中CH4与物质X的化学计量数之比为___________。
【答案】 6 失去 金属 增加 CO 3:2
【解析】本题考查元素周期表的特点,原子结构示意图,根据化学式的计算等。根据元素的质量不变确定物质X的化学式。
(1)根据元素周期表中部分元素的相关信息可知碳原子核电荷数是6;
(2)12号元素的原子的最外层电子数是2在化学反应中比较容易失去电子,该元素属于金属元素;
(3)在同一周期中,从左到右各元素的原子最外层电子数逐渐由1增加到8;
(4) 8号元素是氧元素,组成的单质是氧气,一定条件下,2.4gCH4与8.0g O2恰好完全反应,生成5.4gH2O、2.2gCO2和物质X,则X的质量=2.4g+8.0g-5.4g-2.2g=2.8g;2.4g的CH4中含碳元素的质量=2.4g×![]() ×100%=1.8g,氢元素的质量=2.4g-1.8g=0.6g;5.4g的水中氢元素的质量=5.4g×
×100%=1.8g,氢元素的质量=2.4g-1.8g=0.6g;5.4g的水中氢元素的质量=5.4g×![]() ×100%=0.6g,氧元素的质量=5.4g-0.6g=4.8g;2.2g的CO2中碳元素的质量=2.2g×
×100%=0.6g,氧元素的质量=5.4g-0.6g=4.8g;2.2g的CO2中碳元素的质量=2.2g×![]() ×100%=0.6g,氧元素的质量=2.2g-0.6g=1.6g; X中含有碳元素质量=1.8g-0.6g=1.2g的碳,不含有氢元素,含有氧元素的质量为:8.0g-4.8g -1.6g=1.6g,故X中碳原子和氧原子的原子个数比为:
×100%=0.6g,氧元素的质量=2.2g-0.6g=1.6g; X中含有碳元素质量=1.8g-0.6g=1.2g的碳,不含有氢元素,含有氧元素的质量为:8.0g-4.8g -1.6g=1.6g,故X中碳原子和氧原子的原子个数比为: ![]() :
: ![]() =1:1.该物质是一氧化碳,化学式是CO,系数之比等于各自的质量比上各自的相对分子质量之比,故CH 4和一氧化碳的计量数之比为:
=1:1.该物质是一氧化碳,化学式是CO,系数之比等于各自的质量比上各自的相对分子质量之比,故CH 4和一氧化碳的计量数之比为: ![]() :
: ![]() =3:2。
=3:2。

 阅读快车系列答案
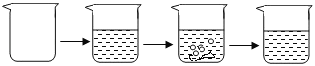
阅读快车系列答案【题目】石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验.
实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
实验图示 |
| |||
实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)