��Ŀ����
����Ŀ��ʯ��ʯ��������Ҫ���֮һ��С��ͬѧΪ��Ѱ�Ҵ��ȳ���85%��ʯ��ʯ����һ��Ʒ���������¶���ʵ�飮
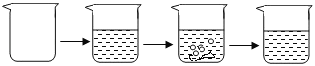
ʵ�鲽�� | �ٳ�ȡ�ձ������� | �ڽ�������������ձ��в����� | �۳�ȡ����ʯ��ʯ��Ʒ�����ձ��У�ʹ֮�����ϡ���ᷴӦ | �ܴ���Ӧ��ȫ���� |
ʵ��ͼʾ |
| |||
ʵ������ | �ձ�������Ϊ50.0g | �ձ������������Ϊ100.0g | ʯ��ʯ��Ʒ��Ʒ������Ϊ12.0g | �ձ������л���������Ϊ107.6g |
��ͨ���������㣺
��1����ʵ�������ɵĶ�����̼�������Ƕ��ٿˣ�
��2����ʯ��ʯ��Ʒ�Ĵ����Ƿ����Ҫ������ʯ��ʯ��Ʒ�е����ʲ������ᷴӦҲ������ˮ��
���𰸡���1����ʵ�������ɵĶ�����̼��������4.4g����2����ʯ��ʯ��Ʒ�Ĵ��Ȳ�����Ҫ��
����������1�����������غ㶨�ɵã���Ӧ�ų�CO2������=��100.0g+12.0g����107.6g=4.4g��
��2����12.0gʯ��ʯ��Ʒ�к�CaCO3����Ϊx
CaCO3+2HCl�TCaCl2+CO2��+H2O
100 44
x 4.4g
![]()
x=![]() =10.0g
=10.0g
��ʯ��ʯ��Ʒ�Ĵ���Ϊ��![]() ��100%=83.3%
��100%=83.3%
��83.3%��85%�����Ը�ʯ��ʯ��Ʒ�Ĵ��Ȳ�����Ҫ��
�𣺣�1����ʵ�������ɵĶ�����̼��������4.4g����2����ʯ��ʯ��Ʒ�Ĵ��Ȳ�����Ҫ��