题目内容
现有铜与另一种金属R的混合物粉末,另一种金属R可能是镁、铁、锌中的一种.现测定其组成,取该混合物粉末16.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体数据记录:
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 12.75 | 9.5 | 6.25 | 5.6 |
(1)该混合物粉末中另一金属R为何种金属?
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是多少?
解:(1)根据实验数据,第一次反应中,35g稀硫酸反应完全,其中溶质H2SO4的质量=35g×14.0%=4.9g,消耗金属的质量=16.0g-12.75g=3.25g;
设R的相对原子质量为x
R+H2SO4═RSO4+H2↑
x 98
3.25g 4.9g
 x=65
x=65
Zn的相对原子质量为65,故金属R为Zn
(2)第三次反应中,H2SO4反应完全,前三次共消耗H2SO4的质量=35g×3×14.0%=14.7g
设Zn与H2SO4反应后生成ZnSO4质量为a,生成的H2质量为b
Zn+H2SO4═ZnSO4+H2↑
98 161 2
14.7g a b
 =
= a=24.15g
a=24.15g
 =
= b=0.3g
b=0.3g
溶液中ZnSO4的质量分数=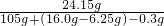 ×100%=21.1%
×100%=21.1%
答:(1)该混合物粉末中另一金属R为金属锌;
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是21.1%.
分析:(1)根据所记录的实验数据可知,第一次加入35.0g稀硫酸完全反应消耗金属的质量为16.0g-12.75g=3.25g;根据可能含有的三种金属在反应中都呈+2价的特点,可假设出反应的化学方程式为R+H2SO4═RSO4+H2↑; 根据反应的化学方程式,由完全反应时消耗硫酸及金属的质量计算出金属的相对原子质量,利用金属的相对原子质量判断金属R为何种金属;
(2)第三次反应中,H2SO4反应完全,由前三次加入稀硫酸中H2SO4的质量,根据反应的化学方程式计算出所得溶液中溶质的质量,再利用质量守恒定律,求出所得溶液的质量,由溶液中溶质质量分数计算公式,计算出第三次加入稀硫酸充分反应后所得溶液中溶质的质量分数.
点评:实验数据的处理:利用每次加入稀硫酸前后固体质量差即反应消耗金属的质量的关系,可判断加入稀硫酸的反应情况.
设R的相对原子质量为x
R+H2SO4═RSO4+H2↑
x 98
3.25g 4.9g
 x=65
x=65Zn的相对原子质量为65,故金属R为Zn
(2)第三次反应中,H2SO4反应完全,前三次共消耗H2SO4的质量=35g×3×14.0%=14.7g
设Zn与H2SO4反应后生成ZnSO4质量为a,生成的H2质量为b
Zn+H2SO4═ZnSO4+H2↑
98 161 2
14.7g a b
 =
= a=24.15g
a=24.15g =
= b=0.3g
b=0.3g溶液中ZnSO4的质量分数=
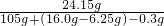 ×100%=21.1%
×100%=21.1%答:(1)该混合物粉末中另一金属R为金属锌;
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是21.1%.
分析:(1)根据所记录的实验数据可知,第一次加入35.0g稀硫酸完全反应消耗金属的质量为16.0g-12.75g=3.25g;根据可能含有的三种金属在反应中都呈+2价的特点,可假设出反应的化学方程式为R+H2SO4═RSO4+H2↑; 根据反应的化学方程式,由完全反应时消耗硫酸及金属的质量计算出金属的相对原子质量,利用金属的相对原子质量判断金属R为何种金属;
(2)第三次反应中,H2SO4反应完全,由前三次加入稀硫酸中H2SO4的质量,根据反应的化学方程式计算出所得溶液中溶质的质量,再利用质量守恒定律,求出所得溶液的质量,由溶液中溶质质量分数计算公式,计算出第三次加入稀硫酸充分反应后所得溶液中溶质的质量分数.
点评:实验数据的处理:利用每次加入稀硫酸前后固体质量差即反应消耗金属的质量的关系,可判断加入稀硫酸的反应情况.

练习册系列答案
相关题目
现有铜与另一种金属R的混合物粉末,另一种金属R可能是镁、铁、锌中的一种.现测定其组成,取该混合物粉末16.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体数据记录:
通过计算(写出计算过程,计算结果保留1位小数),求:
(1)该混合物粉末中另一金属R为何种金属?
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是多少?
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 12.75 | 9.5 | 6.25 | 5.6 |
(1)该混合物粉末中另一金属R为何种金属?
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是多少?


