题目内容
现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末.欲确定R的成分,请你一起完成:
(1)请将银、铁两种金属的元素符号填写在下列金属活动性顺序表中的相应位置.

(2)取少量的金属粉末于试管中,逐滴加入稀盐酸,有气泡产生,则R不可能是
(3)若得到浅绿色溶液,则R是
(1)请将银、铁两种金属的元素符号填写在下列金属活动性顺序表中的相应位置.

(2)取少量的金属粉末于试管中,逐滴加入稀盐酸,有气泡产生,则R不可能是
银
银
.(3)若得到浅绿色溶液,则R是
铁
铁
.R与稀盐酸反应的化学方程式Fe+2HCl═FeCl2+H2↑
Fe+2HCl═FeCl2+H2↑
.分析:(1)根据金属活动性顺序,将银、铁两种金属的元素符号填金属活动性顺序表中的相应位置;
(2)根据金属与酸反应的规律,由金属粉末与稀硫酸反应,有气泡产生,推断金属R;
(3)根据溶液的颜色判断出金属,根据对金属R的推断,写出与盐酸反应的化学方程式.
(2)根据金属与酸反应的规律,由金属粉末与稀硫酸反应,有气泡产生,推断金属R;
(3)根据溶液的颜色判断出金属,根据对金属R的推断,写出与盐酸反应的化学方程式.
解答:解:(1)根据银、铁金属的活动性强弱关系是:铁>氢>银,可判断顺序表最左端空格内为铁,最右端为银;见下图:
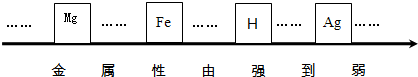
(2)铜不能与稀硫酸反应放出氢气,可判断金属R能与酸反应产生氢气,因此该金属是铁或镁,所以金属R不可能是金属银;
(3)若得到浅绿色溶液,可判断出该金属是铁,铁与硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+2HCl═FeCl2+H2↑.
故答案为:(1)见上图;(2)银;(3)铁;Fe+2HCl═FeCl2+H2↑.

(2)铜不能与稀硫酸反应放出氢气,可判断金属R能与酸反应产生氢气,因此该金属是铁或镁,所以金属R不可能是金属银;
(3)若得到浅绿色溶液,可判断出该金属是铁,铁与硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+2HCl═FeCl2+H2↑.
故答案为:(1)见上图;(2)银;(3)铁;Fe+2HCl═FeCl2+H2↑.
点评:金属活动性顺序中位于氢之前的金属能从酸中置换出氢,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
现有铜与另一种金属R的混合物粉末,另一种金属R可能是镁、铁、锌中的一种.现测定其组成,取该混合物粉末16.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体数据记录:
通过计算(写出计算过程,计算结果保留1位小数),求:
(1)该混合物粉末中另一金属R为何种金属?
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是多少?
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 12.75 | 9.5 | 6.25 | 5.6 |
(1)该混合物粉末中另一金属R为何种金属?
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是多少?

