题目内容
【题目】某校化学兴趣小组在学习了催化剂的知识后,想探究氧化铜能否在过氧化氢溶液分解反应中起到催化作用。请你一起参与他们的探究过程,并完成下列填空。
(提出问题)CuO能不能作过氧化氢溶液分解反应的催化剂呢?
(做出猜想)CuO能作过氧化氢溶液分解反应的催化剂。
(实验验证)
实验 | 实验步骤 | 实验现象 | 实验结论 |
实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | __________ | 常温下H2O2溶液分解速率非常缓慢,放出极少量的氧气 |
实验二 | 在装有等量H2O2溶液的试管中加入少量的CuO,然后将带火星的木条伸入试管中 | 有较多气泡产生,木条复燃 | ___________ |
(讨论与反思)经过讨论,有的同学认为只有上述两个实验,不能证明CuO能作过氧化氢溶液分解反应的催化剂,还要补充一个探究实验。
实验三:
(实验目的)探究在反应前后CuO的质量是否发生改变。
(实验步骤)①准确称量CuO(少量)的质量;
②重复实验二的步骤,待反应结束后,将试管里的物质过滤,洗涤,干燥,称重;
③对比反应前后CuO的质量。
(讨论交流)如果_________,则说明CuO能作过氧化氢溶液分解反应的催化剂。但小华认为,要证明猜想,上述三个实验还不足以说明,还需要再增加一个实验。
(实验目的)_________
(实验结论)CuO能作过氧化氢溶液分解反应的催化剂,请写出CuO催化过氧化氢溶液分解的文字表达式:____________。
【答案】有极少气泡产生,木条不复燃 氧化铜能加快过氧化氢的分解速率 质量相等 探究反应前后氧化铜的化学性质是否改变 过氧化氢![]() 水十氧气
水十氧气
【解析】
[实验验证]实验一:根据实验结论“常温下H2O2溶液分解速率非常缓慢,放出很少量氧气”可知,在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中,只有少量的气泡产生,木条没有复燃;故填:有少量气泡产生,木条没有复燃;
实验二:在装有H2O2溶液的试管中加入少量的CuO,然后将带火星的木条伸入试管中,有较多气泡产生,木条复燃,这说明H2O2溶液在CuO催化作用下分解速率变快,放出很多氧气;故填:H2O2溶液在CuO催化作用下分解速率变快,放出很多氧气;
[讨论交流]由实验三的实验步骤可知,该实验是探究CuO在反应前后的质量是否改变;若CuO在反应前后的质量不改变,则说明CuO能作过氧化氢溶液分解反应的催化剂;故填:CuO在反应前后的质量没有改变;
[实验目的]根据催化剂的概念可知,还需要探究氧化铜的化学性质在反应前后是否发生了改变,过氧化氢在氧化铜的催化作用下分解为水和氧气;
故填:探究CuO在反应前后的化学性质是否改变;
[实验结论]过氧化氢在氧化铜的催化作用下分解为水和氧气;故填:过氧化氢![]() 水十氧气。
水十氧气。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
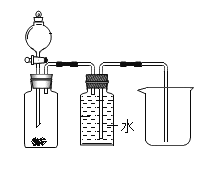
暑假作业安徽少年儿童出版社系列答案【题目】用H2和CuO反应的实验来测定水的组成,如图A所示。请回答下列问题:
(1)实验中,用锌粒和稀硫酸反应制取氢气:
①检验氢气纯度后,先通一段时间氢气,再加热CuO进行反应,其主要目的是_______;
②与CuO反应前,应将制取的H2通过图B所示装置进行干燥,其中所盛的试剂是_______;
(2)实验中,测定的数据如表所示,根据数据计算生成的水中氢氧元素的质量比为:_____(要求有计算式)
实验前 | 实验后 | |
CuO和玻璃管总质量 | 65.6g | 59.2g |
CaCl2和U形管的总质量 | 100.8g | 108.0g |
(3)下列情况下,对实验测定结果一定没有影响的是_______(填序号)
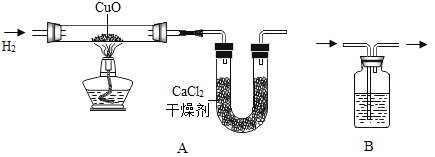
①相对CuO而言,H2是过量的②CuO粉末中含有不与H2反应的杂质③反应中部分CuO变成Cu2O④干燥剂CaCl2有部分失效⑤用固体NaOH代替CaCl2做干燥剂