题目内容
【题目】中国科学家屠呦呦因青蒿素和双氢青蒿素而荣获了诺贝尔奖。兴趣小组在老师的指导下对此进行了相关学习与探究。
(资料查阅)(1)青蒿素易溶于乙醚,在水中几乎不溶。
(2)双氢青蒿素是由碳、氢、氧元素组成的,且其相对分子质量不大于300。
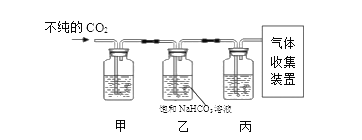
(实验探究1)乙醚浸取法制青蒿素的主要工艺如下图所示:

操作I需要的玻璃仪器主要有:烧杯、漏斗、__________,操作II的原理是利用物质__________的不同。
(实验探究2)小组同学设计如下图所示实验测定双氢青蒿素的组成,将7.1g的双氢青蒿素放在燃烧管C中燃烧,回答下列问题。

(1)装置B中试剂名称为__________,请将装置B中的导管补画完整___________。
(2)写出E中发生反应的化学方程式______________________。
(3)实验测得数据如表:
装置(包括药品)质量 | 实验前/g | 实验后/g |
D | 84.6 | 90.0 |
E | 90.2 | 106.7 |
根据所给数据计算出双氢青蒿素中的碳元素和氢元素的质量比为___________。
(4)写出双氢青蒿素充分燃烧的化学方程式:______________________。
(反思拓展)对“实验探究2”的分析,下列说法正确的是___________。
A 若缺少装置B,则测出的双氢青蒿素中氢元素的质量偏大
B 若缺少氧化铜,则测出的双氢青蒿素中碳、氧元素的质量比偏小
C 若缺少装置F,则测出的双氢青蒿素中碳元素质量偏小。
【答案】玻璃棒 沸点 浓硫酸 
![]() 15:2
15:2 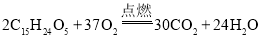 AB
AB
【解析】
[实验探究1]操作I是分离难溶性固体与液体的方法,是过滤操作,需要的玻璃仪器主要有:烧杯、漏斗、玻璃棒;操作II是蒸馏,其原理是利用物质的沸点不同将物质加以分离;故填:玻璃棒;沸点;
[实验探究2](1)制取的氧气中混有水蒸气,可用盛有浓硫酸的装置B来进行干燥,长管进气,短管出气;
故填:浓硫酸; ;
;
(2)二氧化碳与氢氧化钠反应生成碳酸钠和水;故填:CO2+2NaOH=Na2CO3+H2O;
(3)装置D中增重的质量即为生成水的质量,为:90.0g-84.6g=5.4g,其中氢元素的质量为:5.4g×![]() ×100%=0.6g;
×100%=0.6g;
装置E增重的质量即为生成二氧化碳的质量,为:106.7g-90.2g=16.5g,其中碳元素的质量为:16.5g×![]() ×100%=4.5g;
×100%=4.5g;
双氢青蒿素中的碳元素和氢元素的质量比为:4.5g:0.6g=15:2;故填:15:2;
(4)7.1g的双氢青蒿素含氧元素的质量为:7.1g-0.6g-4.5g=2g
则双氢青蒿素中碳、氢、氧原子个数比为:![]() =15:24:5,即双氢青蒿素的化学式为C15H24O5。
=15:24:5,即双氢青蒿素的化学式为C15H24O5。
双氢青蒿素与氧气在点燃的条件下反应生成二氧化碳和水;故填:2C15H24O5+37O2![]() 30CO2+24H2O;
30CO2+24H2O;
[反思拓展]A.若缺少装置B,没有对氧气进行干燥,则装置D增重偏大,计算出水的质量偏大,测出的双氢青蒿素中氢元素的质量偏大,故正确;
B.CuO可以将青蒿素不完全燃烧生成的CO氧化成CO2,若缺少氧化铜,则装置E增重偏小,即测得二氧化碳的质量偏小,所以测出的双氢青蒿素中碳、氧元素的质量比偏小,故正确;
C.若缺少装置F,则E会吸收空气中的二氧化碳与水蒸气,质量偏大,即测得二氧化碳的质量偏大,测出的双氢青蒿素中碳元素质量偏大;故填:AB。

【题目】某研究小组发现,原本银白色有金属光泽的镁,漏置在空气中一段时间后,表面覆盖一层灰黑色物质。该小组同学进行了如下探究。
探究一:灰黑色物质成分
(猜想与假设)
小明说:灰黑色可能含有MgO、Mg(OH)2、Mg2(OH)2CO3。小芳说:不可能是MgO,原因是______________________________。
(进行试验)
实验编号 | 实验操作 | 实验现象 |
① | 取灰黑色粉末于试管中,滴加稀盐酸 | 有气泡产生 |
② | 将产生的气体通入澄清的石灰水中 | 石灰水变混浊 |
(得出结论)
得出结论灰黑色物质中一定含有________________;写出实验②中发生的化学方程式________________。
探究二:产生灰黑色物质的原因
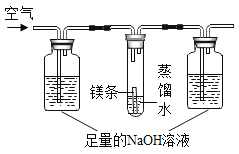
在猜想产生灰黑色物质的原因时,小华认为,镁条变黑与N2无关,其理由是____________。为进一步探究产生灰黑色物质的原因,设计如图实验,其中NaOH溶液的作用是_________________,经过一段时间,试管中镁条基本无变化。
(得出结论)镁表面的黑色物质是美与空气中O2、CO2、H2O共同作用的结果。
(实验拓展)①用镁条实验前一般要进行的操作是_______________。 ②保存镁条的方法是_______________。