��Ŀ����
����Ŀ��ijУѧ��ѧϰ�˽����Ļ�ѧ���ʺ�������������̽�֣�
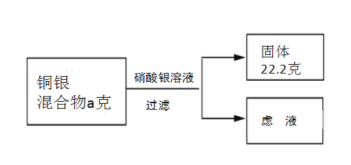
��ʵ���ҷ�Һ�к����Ȼ�ͭ���Ȼ��������Ը÷�Һ��������ʵ�飺
��.����M������ ��14�� ��
II.д�������м���ϡ�����һ�������ķ�Ӧ��ѧ����ʽ ��15�� ��
��.д����Һ�����ʵ���� ��16�� ��
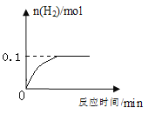
����ͭ��������У�����������������Ϊ10%����������Һ340 g��ǡ����ȫ��Ӧ��������ͼ�ṩ�����ݼ���������.�������ͭ�����ʵ�����II. a����ֵ��
���𰸡���14������
��15��Fe +2 HCl ===Fe Cl2 + H2��
��16���Ȼ�п��1�������Ȼ�п���Ȼ�������1������Cu+2AgNO3====Cu��NO3��2+2Ag ��1����
��������
�����������14���������Թ����Һ�����ɲ��ù��˵ķ�����п���ܽ��Ȼ�ͭ���Ȼ������е�ͭ�����û��������������м���ϡ����������������˵��������һ����������Ҳ�п��ܼ����п�۹��������ܺ���п����һ��������Ӧ��������ϡ���ᷴӦ�������Ȼ���������������16����п��ͭ������ȫ�û�����������Һ��ֻ�����Ȼ�п������ͭ��ȫ�û���ɺ�п��һ�������û�����������Һ�к��Ȼ�п���Ȼ��������������ȸ����������������Լ�������������ʵ��������û�ѧ����ʽ������������ͭ�����ʵ��������岽�����£�
n��AgNO3��=340g��10%/170g/mol=0.2mol ��1����
����ͭ�����ʵ�����XĦ��
Cu+2AgNO3��Cu��NO3��2+2Ag ��1����
1 2
X 0.2
��1����
![]()
X=0.1mol
��1����
�� a=7 ��1����
II.�������������������û�ѧ����ʽ�����������������ͭ���������ɡ�
�⣺��������������ΪX������ͭ������ΪY
����������=340g��10%=34g
Cu+2AgNO3====Cu��NO3��2+2Ag
64 340 216
Y 34g X
340/216= 34g/X X=21.6g
340/64= 34g/Y Y=6.4g
��ͭ�����������a������=6.4g+��22.2g-21.6g��=7g
����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�