题目内容
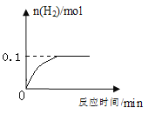
【题目】取7.8g锌与铜的混合物与49.0g稀硫酸恰好完全反应,产生氢气的物质的量与时间关系如图所示。
①计算样品中所含锌的质量 (20) (根据化学方程式列式计算);
②反应后溶液中溶质的质量分数为 (21) (计算结果精确到0.1%)。
【答案】①6.5g ②29.1%
【解析】
试题分析:根据图像可知,反应结束后产生的氢气物质的量为0.1mol,根据化学方程式:Zn + H2SO4 === ZnSO4 + H2↑中Zn、ZnSO4与H2的物质的量的关系
解:设设样品中有锌xmol,生成硫酸锌y mol
Zn + H2SO4 === ZnSO4 + H2↑
1mol 1mol 1mol
x y 0.1mol
1:x=1:o.1 x=0.1 mol
① m(Zn)=0.1×65=6.5g
1:y=1:0.1 y=0.1 mol
②m(ZnSO4)=0.1×161=16.1g
反应后溶液的质量=6.5+49.0-0.2=55.3g
反应后溶液中溶质的质量分数为ZnSO4%=16.1/55.3=29.1%

练习册系列答案
相关题目