题目内容
【题目】(14分)某兴趣小组用图1所示流程制取氧气,并回收提纯氯化钾和二氧化锰
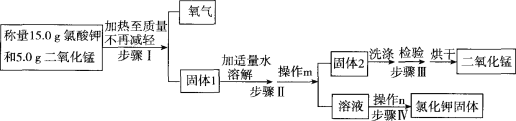
回答下列问题:
(1)请写出制取氧气的化学方程式 。在反应过程中,若收集到氧气3.2g时,其物质的量为 mol。在氯酸钾和二氧化锰混合物中,此时质量分数增加的物质是 ,当它的质量分数不在变化的实验判断依据是 。
(2)在回收提纯的过程中需要控制水的用量,原因有 (填标号)。
A.提高实验效率
B.保证固体1全部溶解
C.节约能源
(3)①写出图2中仪器a、b的名称:
a , 。
②步骤Ⅱ中的操作m应选择图2中 (填“甲”或“乙”)装置,该操作中玻璃棒的作用是 。

③步骤Ⅲ中用酸化的硝酸银(AgNO3)溶液检验洗出液中是否含有氯化钾,该检验方法的原理为 (用化学方程式表示)。
(4)实验结束后,称得回收到的氯化钾的质量比理论值小,可能的原因有 (写一点)。
(5)取少量烘干后二氧化锰放入盛有一定浓度过氧化氢溶液中,立刻有大量气泡产生,写出该反应的化学方程式 ,该反应属于 反应。此反应说明二氧化锰与氯酸钾混合加热后不变的是 。
【答案】(1)2KClO3![]() 2KCl+3O2↑ 0.1 MnO2 加热至质量不在减轻
2KCl+3O2↑ 0.1 MnO2 加热至质量不在减轻
(2)AC
(3)①铁架台 酒精灯 ②甲 引流 ③KCl+AgNO3→AgCl↓+KNO3
(4)蒸发过程中,氯化钾固体飞溅
(5)2H2O2 MnO2 2H2O+ O2↑ 分解 化学性质
【解析】
试题分析:(1)加热氯酸钾和二氧化碳混合物制取氧气的化学方程式:2KClO3![]() 2KCl+3O2↑;若收集到氧气3.2g时,其物质的量=3.2g÷32g/mol= 0.1 mol ;由于反应生成了氧气,使得剩余的固体质量减少,而二氧化锰在反应中起催化作用,质量一直不变,故在氯酸钾和二氧化锰混合物中,此时质量分数增加是MnO2;当它的质量分数不在变化的实验判断依据:加热至质量不在减轻,即反应结束
2KCl+3O2↑;若收集到氧气3.2g时,其物质的量=3.2g÷32g/mol= 0.1 mol ;由于反应生成了氧气,使得剩余的固体质量减少,而二氧化锰在反应中起催化作用,质量一直不变,故在氯酸钾和二氧化锰混合物中,此时质量分数增加是MnO2;当它的质量分数不在变化的实验判断依据:加热至质量不在减轻,即反应结束
(2)在回收提纯的过程中需要控制水的用量,原因有:加入适量水可以减少蒸发所用的时间,从而提高实验效率,同时可以节约能源,故选AC
(3)常见仪器的识记:①铁架台 酒精灯
②步骤Ⅱ是将不溶于水的二氧化锰和溶于水的KCl分离,应采用过滤操作,故操作m应选择图2中甲;该操作中玻璃棒的作用是引流
③步骤Ⅲ中用酸化的硝酸银(AgNO3)溶液检验洗出液中是否含有氯化钾,该检验方法的原理为:KCl+AgNO3→AgCl↓+KNO3
(4)实验结束后,称得回收到的氯化钾的质量比理论值小,可能的原因有:蒸发过程中,溶于飞溅或氯化钾固体飞溅
(5)二氧化锰放入盛有一定浓度过氧化氢溶液中,立刻有大量气泡产生,反应的化学方程式为:2H2O2 MnO2 2H2O+ O2↑;该反应由一种物质生成两种物质,属于分解反应;此反应说明二氧化锰与氯酸钾混合加热后不变的是:化学性质

【题目】氯碱工业用电解饱和食盐水制取氯气、烧碱。电解饱和食盐水的化学方程式:
2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
化学兴趣小组同学认为用上述方法制备的烧碱不纯,进行如下探究,请回答有关问题。
①甲同学认为该烧碱可能含有少量食盐,为了检验食盐是否存在,进行了如下实验:
实验步骤 | 实验现象 | 解释与结论 |
1.取少量烧碱溶于水,滴加过量稀硝酸。 | 无明显现象 | 解释:滴加过量稀硝酸的目的是 (11) 。 |
2.再滴加 (12) 。 | (13) | 结论:烧碱中含有少量食盐。 写出有关化学方程式: (14) 。 |
②甲同学在上述检验后,根据氢氧化钠与氯化镁溶液反应:2NaOH+MgCl2→Mg(OH)2↓+2NaCl。测氢氧化钠的质量分数,设计实验步骤下图所示。
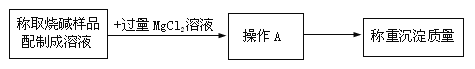
加入过量氯化镁溶液的目的是 (15) 。
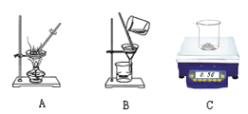
操作A的仪器或装置如下图所示,则操作A应选择 (16) (填字母)装置。根据上述实验步骤操作,称量与计算准确。利用沉淀物的质量计算氢氧化钠的质量分数偏大,则可能的原因是 (17) 。
③乙同学依据甲检验,利用盐酸与氢氧化钠的反应测NaOH百分含量。实验过程如下:称取烧碱样品ag,溶于水,滴加盐酸至过量。滴加盐酸的体积与pH变化规律如图。

则根据实验与图象中的有关数据能否得出NaOH百分含量。
如果能,说明理由 (18) ;
如果不能,需要补充的数据是 (18) 。