题目内容
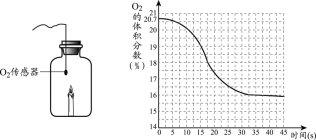
【题目】已知碳酸钙在高温下可分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3![]() CaO+CO2↑,同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如下表:
CaO+CO2↑,同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如下表:
反应时间∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为_____克。
(2)求该石灰石中含CaCO3的质量分数(写出计算过程)。_____
【答案】22g 62.5%
【解析】
本题考查了根据化学方程式进行相关的计算。根据方程式可知固体减少的质量是产生的二氧化碳的质量。
(1)由于固体的质量由80g变为58g,减少了22g,说明生成的气体的质量为22g;
(2)设:样品中含CaCO3的质量为x,
CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
100 44
x 22g
![]() x==50g
x==50g
样品中的质量分数=![]() ×100%=62.5%。
×100%=62.5%。
答:(1)当石灰石完全反应后,生成CO2的质量为22g;
样品中CaCO3的质量分数为62.5%。

【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_____产生,反应的化学方程式是_____。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
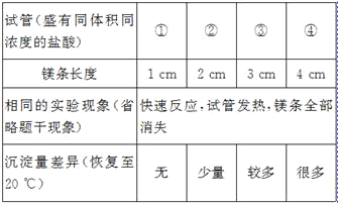
[得出结论]镁条与盐酸反应产生白色沉淀与_____有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_____(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _____,白色沉淀_____ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_____ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_____ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |