��Ŀ����
����Ŀ�������ͼ1�ش����⣺
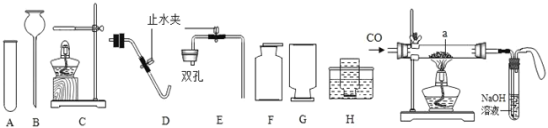
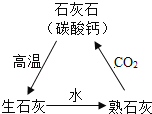
ͼ1 ͼ2
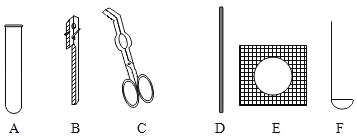
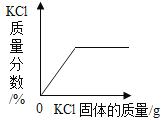
��1������A��������_____������B��������_____
��2����KClO3��MnO2�����ȡ���ռ�����O2��Ӧѡ��ͼ�е�_____������ţ�����Ӧ�Ļ�ѧ����ʽ_____
��3��ʵ������ȡ���ռ�CO2��Ӧѡ��ͼ�е�_____������ţ�����Ӧ�Ļ�ѧ����ʽ_____����μ����Ѽ���һƿCO2����_____
��4������ͼ2����CO��ԭFe2O3��ʵ�飬��������ͨ��COǰӦ��_____����Ӧʱa��������Ϊ_____����װ���������������_____
���𰸡��Թܣ� ����©�� ACDH�� 2KClO3![]() 2KCl+3O2�� ABEF CaCO3+2HCl��CaCl2+H2O+CO2�� ��ȼ�ŵ�ľ���쵽����ƿ�ڣ�������Ϩ�����Ѽ��� ���CO�Ĵ��� ��ɫ��ĩ��� �ռ�β���е�һ����̼����ֹ��Ⱦ����
2KCl+3O2�� ABEF CaCO3+2HCl��CaCl2+H2O+CO2�� ��ȼ�ŵ�ľ���쵽����ƿ�ڣ�������Ϩ�����Ѽ��� ���CO�Ĵ��� ��ɫ��ĩ��� �ռ�β���е�һ����̼����ֹ��Ⱦ����
��������
��1������A���������Թܣ�����B�������dz���©����
��2����KClO3��MnO2�����ȡ���ռ�����O2����Ӧ���״̬�ǹ�̬����Ӧ�����Ǽ��ȣ����Է���װ��ѡA��C��D��������������ˮ�������ռ�����ѡ��ˮ�����ռ�����������ѡH����KClO3��MnO2�����ȡ���ռ�����O2��Ӧѡ��ͼ�е�ACDH��KClO3��MnO2�Ĵ����������ȷֽ������Ȼ��غ���������Ӧ�Ļ�ѧ����ʽ��2KClO3![]() 2KCl+3O2����
2KCl+3O2����
��3��ʵ������ȡ���ռ�CO2��ҩƷ��̼��ƺ�ϡ���ᣬ��Ӧ���״̬�ǹ�̬��Һ̬����Ӧ��������Ҫ���ȣ����Է���װ��ѡABE��������̼������ˮ���ܶȱȿ������ܶȴ������ռ�װ��ѡF��ʵ������ȡ���ռ�CO2��Ӧѡ��ͼ�е�ABEF��̼��������ᷴӦ�����Ȼ����ơ�ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽCaCO3+2HCl��CaCl2+H2O+CO2����������̼һ������²�ȼ��Ҳ��֧��ȼ�գ���ʹȼ�ŵ�ľ��Ϩ�����Լ����Ѽ���һƿCO2����ķ����ǣ���ȼ�ŵ�ľ���쵽����ƿ�ڣ�������Ϩ�����Ѽ�����
��4������CO��ԭFe2O3��ʵ�飬��������ͨ��COǰ��Ϊ��ֹ��ը��Ӧ�ȼ��CO�Ĵ��ȣ���������һ����̼�ڸ��������·�Ӧ�������Ͷ�����̼����Ӧʱa��������Ϊ��ɫ��ĩ��ڣ���װ����������������ռ�β���е�һ����̼����ֹ��Ⱦ������

 ������������ϵ�д�
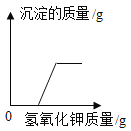
������������ϵ�д�����Ŀ�� ��ҵ������ͨ��������FeC13���ʻ�ɫ��С��Ϊ�ⶨij��ҵ������HCl�ĺ�����������ʵ�飬ȡij��ҵ����50g���μ�������������Ϊ20%��NaOH��Һ����Ӧ�����У��������NaOH��Һ������������ֵʱ���Գ�ַ�Ӧ��������Һ�����������˲ⶨ�������������±�������ݱ����ͼ������������⣺
����NaOH��Һ������/g | 25 | 50 | 75 | 100 |
������Һ������/g | 75 | 100 | 125 | m |

��1����ʼû�в���������ԭ����_____��
��2����ù�ҵ������HCl����������______��д��������̣���
��3��m��_____�����������λС����
����Ŀ��ʵ�������Ʊ��ͳ���ʯ��ˮ����������Ϊ10%������������Һ���������й�ʵ�顣
�±���20��ʱ�������ʵ��ܽ�����ݡ�
���� | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
�ܽ��/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)������Һ����������100g10%����������Һ�Ļ��������ǣ�
��ȡ�������ƹ��塪��ȡˮ���ܽ⡪װƿ����ǩ��

�ٳ�ȡ�������ƹ��������_____________g��
����֪ˮ���ܶ�Ϊ1g/cm3����100mL��Ͳ��ȡ�����ˮ��_______����ˮ��Һ�档
��װƿ������ǩ���ڱ�ǩ����д��_______________________________��
(2)��������̽��ʵ�飬20��ʱ���������ݻش���������:
���ͳ���ʯ��ˮ��ͨ��CO2ֱ��������������CaCO3����ת��ΪCa(HCO3)2���ɹ۲쵽��������________________________________��
����10%����������Һ��ͨ��CO2ֱ��������������Na2CO3����ת��ΪNaHCO3,�ɹ۲쵽��������_______________________________________________________��
������������4.4gCO2���豥�ͳ���ʯ��ˮ����������Ϊ___________g������10%����������Һ����������Ϊ__________g��(��������ȷ����λ)