题目内容
某气体中可能含有CO、CO2和H2中一种或几种,为了确定该气体的组成,某实验小组按如下装置进行实验。
(1)实验现象:A、D装置中均有白色沉淀产生;B装置中黑色粉末变成亮红色;C装置中有明显现象,该现象是 。
(2)依据上述实验现象,该气体的组成是 。装置A中澄清石灰水的作用是 ,写出该反应的化学方程式 。
(3)问题与反思:实验结束后,某同学对上述实验设计提出质疑,认为没有达成实验目的。下面请你一起对上述实验装置中所存在的问题进行改进: 。
(1)白色变成蓝色 (2)一定含有CO、CO2,可能含有H2 检验并除尽二氧化碳 Ca(OH)2+CO2 →CaCO3↓+H2O (3)无法确认H2是否存在,所以应在AB装置之间加一个干燥装置,D装置应有尾气处理
解析试题分析:(1)无水硫酸铜是白色粉末,遇到水后会生成蓝色晶体五水硫酸铜;根据A、D装置中均有白色沉淀产生B装置中黑色粉末变成亮红色可推断原混合气体中一定含有CO、CO2,由于从A装置出来的气体中可能会带一部分水蒸气,所以即使C装置有明显变化也不能证明原混合气体中是否含有氢气;装置A中的清石灰水是为了检验并除尽二氧化碳,该反应的化学方程式应根据反应物、生成物和反应条件进行书写;(3)为了证明氢气是H2是否存在,应在AB装置之间加一个干燥装置,为防止一氧化碳污染环境,应在D装置末端加装一个尾气处理装置。
考点:一氧化碳、二氧化碳、氢气、硫酸铜的性质

 智慧小复习系列答案
智慧小复习系列答案假日里,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析
| 白色粉末的成分 | 形 成 的 原 因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应,化学方程式为: |
| 可能是 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质析出 |
经过反复思考,同学们认为白色粉末还可能是 的混合物。
(2)设计实验:甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下图),认为甲同学的结论不严密,理由是 。
| | OH- | Cl- | CO32- | NO3- |
| Ca2+ | 微 | 溶 | 不 | 溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实 验 步 骤 | 可能观察到的现象 | 结 论 |
| 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | | 白色粉末中含有Ca(OH)2 |
| 往上述试管内残留的固体中加入足量稀盐酸 | 固体溶解,产生气泡 | 白色粉末中 |
| 由上述实验可知白色粉末的成分是: | ||
(3)交流与反思
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是_______(填序号)。
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂
新课标化学教材九年级上册(2012教育部审定)“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| Ⅳ分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
【实验结论】
(1)A中产生的气体是 ;
(2)实验Ⅱ、Ⅲ证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的化学方程式 。
【实验评价】
实验设计Ⅳ的目的是 ;
若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
【实验拓展】
查阅资料得知,CuO、CuSO4、、、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。
下列有关催化剂的说法中正确的是 。
MnO2只能作过氧化氢溶液分解的催化剂
同一个化学反应可以有多种催化剂
催化剂只能加快化学反应的速率
用作催化剂的物质不可能是其他反应的反应物或生成物
酶是一种重要的生物催化剂,它属于糖类
【拓展计算】如果需制备氧气9.6克,至少需要5%过氧化氢 克。
酸、碱、盐是几类有广泛用途的重要化合物.
(1)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条.
(2)氢氧化钙是一种常见的碱,列举其在生产、生活中的一种用途.
(3)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图)的溶液,他们对此产生了兴趣.
提出问题:这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
①小明根据标签上的组成元素认为一定不可能是 (提示:只有其中一种).
②小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是:
设计实验:为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| 静置一段时间后,倾去上层清液,向沉淀中滴加稀盐酸 | 白色沉淀全部溶解,并产生大量气泡 |
实验反思:④小强认为上述设计实验还可简化,也能达到目的.小强的实验操作是:
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.

室验室开放日,小明、小佳、小华、小丽等同学来到实验室,看到实验桌上摆放着四瓶无标签的试剂,分别是两瓶固体和两瓶液体,同学们决定对“固体与液体”之间的反应进行一系列探究.
(1)小明同学从一瓶固体和一瓶液体中各取少量试剂于试管中进行混合,立即产生了一种无色气体,对气体是何物质,同学们进行了大胆的猜想,小佳同学的
猜想可能是① ;② ;….
(2)我想设计一个实验证明小佳同学猜想①是正确的,实验设计如下:
| 实验步骤 | 现象及结论 |
| | |
(3)小华想用如图给定的收集装置收集一瓶小佳同学猜想②中的气体,则气体由 (填a或b)端进入.

(4)小丽同学从另外两瓶试剂中各取少量试剂于试管中,发现混合后,固体发生了变化,但无气泡放出.同学们对加入试管中的固体和液体从不同的反应类型、物质类别等方面进行了大胆的猜想:
猜想一: ;
猜想二: ;
猜想三: ;
实验是研究物质的性质及其变化规律的重要手段,请根据下述实验内容回答问题。
|
|
|
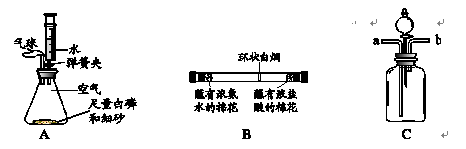
1.白磷的着火点为40℃。
2.浓盐酸和浓氨水均是具有挥发性的无色液体,挥发出的氯化氢气体和氨气反应生成氯化铵。
(1)图A为测定空气中氧气含量的实验。锥形瓶内空气体积为220mL,注射器中水的体积为50mL,实验时先夹紧弹簧夹,将锥形瓶底部放入热水中,白磷很快被引燃,白磷燃烧的化学方程式为 。将锥形瓶从热水中取出,待白磷熄灭、锥形瓶冷却到室温后,打开弹簧夹,可观察到的现象是 。
(2)图B为探究分子运动的实验,在玻璃管两端同时放入蘸有试剂的棉花,发现在玻璃管内形成了环状白烟且偏向蘸有浓盐酸的棉花一端。由此得到的结论是 。
(3)在验证二氧化碳与水反应实验中,为证明使石蕊变色的物质是碳酸而不是水或二氧化碳,使用如图C所示的装置,应采取的实验操作顺序是 (填数字序号,可重复选用)。
①从b端通氮气;②将用石蕊溶液染成紫色的干燥纸花放入广口瓶中;③从a端通二氧化碳;④从分液漏斗中滴加适量水
老师请化学兴趣小组的同学帮助他将失去标签的碳酸钠、稀盐酸、氯化钠、氢氧化钠和氯化钙溶液鉴别出来.重新贴好标签.为了区分这五种溶液,将试剂瓶编号为A,B,C,D,E,该小组同学进行了如下探究:
| | 实验步骤 | 实验现象 | 实验结论 |
| 步骤一 | 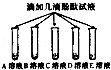 | B,C溶液呈现红色 A,D,E溶液颜色无明显变化 | B,C溶液显 性 |
| 步骤二 | 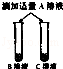 | B,C溶液红色均消失, 且C溶液中产生大量气泡 | 可确定B为 溶液;A与C的反应通常 不用作实验室制取气体的 原因是 |
| 步骤三 |  | E中无明显现象, D中的现象为 | 确定E为氯化钠溶液, 则D溶液与所加试剂发生反应的化学方程式为 |
