题目内容
实验是研究物质的性质及其变化规律的重要手段,请根据下述实验内容回答问题。
|
|
|
1.白磷的着火点为40℃。
2.浓盐酸和浓氨水均是具有挥发性的无色液体,挥发出的氯化氢气体和氨气反应生成氯化铵。
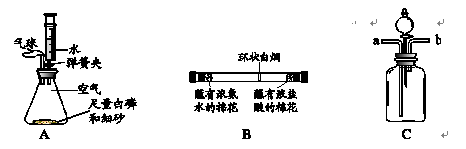
(1)图A为测定空气中氧气含量的实验。锥形瓶内空气体积为220mL,注射器中水的体积为50mL,实验时先夹紧弹簧夹,将锥形瓶底部放入热水中,白磷很快被引燃,白磷燃烧的化学方程式为 。将锥形瓶从热水中取出,待白磷熄灭、锥形瓶冷却到室温后,打开弹簧夹,可观察到的现象是 。
(2)图B为探究分子运动的实验,在玻璃管两端同时放入蘸有试剂的棉花,发现在玻璃管内形成了环状白烟且偏向蘸有浓盐酸的棉花一端。由此得到的结论是 。
(3)在验证二氧化碳与水反应实验中,为证明使石蕊变色的物质是碳酸而不是水或二氧化碳,使用如图C所示的装置,应采取的实验操作顺序是 (填数字序号,可重复选用)。
①从b端通氮气;②将用石蕊溶液染成紫色的干燥纸花放入广口瓶中;③从a端通二氧化碳;④从分液漏斗中滴加适量水
(1)4P + 5O2 2P2O5
2P2O5
注射器中的水流入锥形瓶,当注射器中的水还剩约6mL时停止下流。
(2)分子在不断运动,氨分子运动速率大于氯化氢分子运动速率(氯化铵为白色固体等)
(3)②③①④③(2分)
解析试题分析:空气中含有21%氧气、78%氮气、0.94%稀有气体、0.03%二氧化碳、0.03%其它气体和杂质等。空气中氧气含量的测定,氧气体积约占空气体积的1/5,白磷着火点低,易燃烧,化学方程式为4P + 5O2  2P2O5,燃烧后消耗氧气,使锥形瓶内气压减小,小于外部大气压,注射器中的水被吸入锥形瓶内。消耗氧气体积为220mL×1/5="44" mL, 注射器中的水还剩50 mL - 44mL="6" mL
2P2O5,燃烧后消耗氧气,使锥形瓶内气压减小,小于外部大气压,注射器中的水被吸入锥形瓶内。消耗氧气体积为220mL×1/5="44" mL, 注射器中的水还剩50 mL - 44mL="6" mL
(2)分子在不断运动,氨分子相对分子质量小运动速率快,氯化氢相对分子质量大运动速率慢,氨分子运动速率大于氯化氢分子运动速率;生成的氯化铵为白色固体
(3)②将用石蕊溶液染成紫色的干燥纸花放入广口瓶中;③从a端通二氧化碳,可证明二氧化碳不能使石蕊变红,①从b端通氮气,赶走瓶内二氧化碳,④从分液漏斗中滴加适量水,此时水不能使石蕊变色,从a端再通二氧化碳,二氧化碳与水反应生成的碳酸是石蕊变红。
考点:空气中氧气含量的测定、分子在不断运动、二氧化碳的性质

某校化学研究学习小组的同学在一次活动中查阅资料时发现,单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动。请你参与他们的这次活动,并解决的关问题:
【提出问题】
木炭与氧化铜反应除生成单质铜外,另一种生成物是什么?
【猜想与假设】
(1)可能是CO。(2)可能是CO2。
【实验准备】
(1)他们在互联网上收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色。
(2)CO2的检验方法是(用化学方程式表示)___________________。
【设计实验】如下装置图:
【实验与结论】
| 实验现象 | 实验结论 |
| A中固体由黑色变成红色 | 说明有________________生成 |
| B中黄色试纸没有变蓝 | 说明没有________________生成 |
| C中_________________________ | 说明有CO2生成 |
【反思与评价】
(1) 如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是____________。
(2)假设产生的气体是CO和CO2的混合气体,能否直接用点燃的方法来检验CO2?___(填“能”或“不能”),原因是_______________。
某化学兴趣小组回收利用废旧干电池。
实验1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。兴趣小组的同学们设计回收物质的流程如图1所示。
(1)操作1和操作2的名称都是___________,该操作中玻璃棒的作用是__________。
(2)灼烧滤渣l的目的是____________________________。
实验2利用外壳回收物锌制取氢气及相关探究
(3)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口接____(填“a”或“b”) 进;选用仪器F测量排出水的体积,仪器F名称是___________________。
(4)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前10min内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 | 试 剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | | |
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
①比较实验a和实验b,可以得到的结论是__ __。
②为了研究硫酸浓度对反应快慢的影响,需比较实验___ _和实验____(填编号).
③控制其他条件相同,需控制的条件是__ __(列举一种条件即可)。
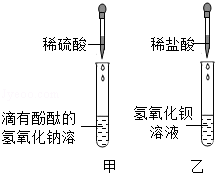
某兴趣小组的同学在老师的指导下,对一瓶没有塞橡皮塞的氢氧化钙溶液进行探究,请你一起参与.
【提出问题】该氢氧化钙溶液是否全部变质?
【猜想与假设】猜想①:氢氧化钙溶液可能全部变质,变成碳酸钙.
猜想②:氢氧化钙溶液可能部分变质,其成分是 .
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取样于试管中,滴加稀盐酸 | 有 生成 | 原溶液里一定有碳酸钙 |
| (2)另取样于试管中,滴加酚酞试液 | 溶液成红色 | 原溶液一定有 |
【实验结论】综合上述实验(1)、(2),你得出的结论是猜想 成立.
【反思拓展】(1)氢氧化钙露置于空气中容易变质,原因是 (用化学方程式表示).
(2)在分析化学反应的物质成分时,除了考虑生成物外,还需考虑的是 .
请你参与某学习小组的探究活动,并回答相关问题.
某化学兴趣小组的同学把氢氧化钠的片状固体放在表面皿中,离开实验室.三天后进行观察.
发现问题:三天后片状固体变成白色粉末状固体了
提出问题:“白色粉末固体物质是什么?”
建立假设:
设计实验:请你来完成以下实验,把相关内容填写在表格中.
| 实验方法及操作 | 可能观察到的现象 | 实验结论 |
| | | |
反思与应用:我们学过的哪些物质还具有这样的性质? ,应如何保存这些物质 .