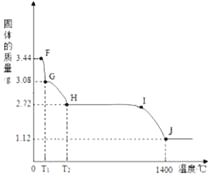
题目内容
【题目】如图中是初中化学常见的一些物质,A是石灰石的主要成分,K是最常用的溶剂,D是胃酸的主要成分,E是金属单质,F是金属氧化物,G溶液呈浅绿色,J溶液呈蓝色,物之间的转化关系如图。“﹣”表示相连的两物质之间能发生反应,“→”表示一种物质能转化成另一种物质,部分反应条件、反应物、生成物已略去。
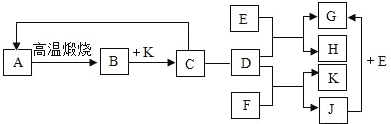
(1)请根据已知条件推断下列物质的化学式:B是_____;K是_____;
(2)请写出下列反应的化学方程式:
C→A:_____;
D+E→G+H:_____;
J+E→G:_____。
【答案】CaO H2O Ca(OH)2+ CO2== CaCO3↓+H2O 2HCl+ Fe== FeCl2+H2↑ CuCl2+ Fe== FeCl2+Cu
【解析】
根据题意A是石灰石的主要成分,得A是CaCO3,K是最常用的溶剂,应该为水(H2O),D是胃酸的主要成分,是盐酸(HCl),E是金属单质,F是金属氧化物,G溶液呈浅绿色,有亚铁离子,J溶液呈蓝色,有铜离子;
A是石灰石的主要成分,得A是CaCO3,K是最常用的溶剂,应该为水(H2O),D是胃酸的主要成分,是盐酸(HCl),E是金属单质,F是金属氧化物,G溶液呈浅绿色,有亚铁离子,J溶液呈蓝色,有铜离子;由A→B,条件是高温,可知是工业上制二氧化碳气体,高温煅烧石灰石;K是最常用的溶剂水(H2O),故可知B是CaO,CaO和水反应生成C(Ca(OH)2),C(Ca(OH)2)又可通入CO2后生成CaCO3;C(Ca(OH)2)可与盐酸反应,盐酸和金属单质E反应,生成浅绿色的G,故可知E为铁单质,G为氯化亚铁,H为氢气;
盐酸和金属氧化物F反应生成蓝色的J,故可知F为氧化铜,J为氯化铜;J(CuCl2)和E(Fe)可反应生成G(FeCl2)。
(1)根据分析可知B是CaO;K是H2O;故填:CaO;H2O
(2)C →A的方程式为石灰水通入二氧化碳生成碳酸钙和水:
Ca(OH)2+ CO2== CaCO3↓+H2O
D + E →G +H:是盐酸和铁单质反应生成氯化亚铁和氢气:2HCl+ Fe== FeCl2+H2↑
J + E →G:是氯化铜和铁单质反应生成铜和氯化亚铁:CuCl2+ Fe== FeCl2+Cu;故填:Ca(OH)2+ CO2== CaCO3↓+H2O ;2HCl+ Fe== FeCl2+H2↑;CuCl2+ Fe== FeCl2+Cu

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案