题目内容
【题目】某实验小组在实验室制得的CaSO42H2O固体中含有少量的CaCO3,该小组的同学对所得固体进行如下探究:
(实验一)测定固体中CaSO42H2O和CaCO3的质量比x:y
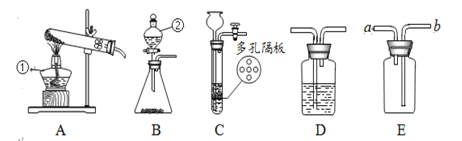
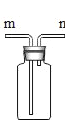
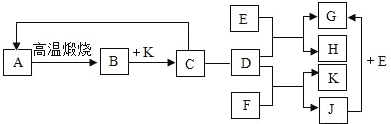
实验小组利用如图所示的装置进行实验。(碱石灰是CaO和NaOH的混合物,夹持仪器省略,药品足量)

(1)实验前首先要检查装置气密性,再装入样品,并通入一段时间的空气后,再给样品加热。装置A的作用是_____。
(2)已知CaSO42H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将_____(填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的_____(选填序号)两个数据组合也可求出x:y的值。
(3)有同学提出为了使得到的数据准确,在B中反应结束后的操作很重要,该操作是_____。
(实验二)研究CaSO42H2O加热分解的产物。
查阅资料:CaSO42H2O受热会逐步失去结晶水;SO2气体能使酸性KMnO4溶液褪色。
(1)分离所得的CaSO42H2O含有CaCO3,可用盐酸除去,该的化学反应方程式:_____;
(2)将实验一所用装置中的D换成盛有酸性高锰酸钾溶液的洗气瓶,其余装置不变。
(3)取纯净CaSO42H2O固体3.44g,放在实验装置B中进行加热,测定固体质量随温度的变化情况,并用带火星的木条在E装置右侧导管口检验,记录数据和实验现象如下:
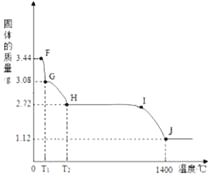
F点 | G点 | H点 | I点 | |
酸性KMnO4溶液 | 不褪色 | 不褪色 | 不褪色 | 褪色 |
带火星的木条 | 不复燃 | 不复燃 | 不复燃 | 复燃 |
G点固体的化学式是_____。
【答案】吸收空气中的水蒸气和二氧化碳 偏小 b、c 继续通入空气一段时间 CaCO3+2HCl═CaCl2+H2O+CO2↑ CaSO4H2O
【解析】
(实验一)
(1)该实验是通过测定反应中生成的水的质量和二氧化碳质量,测定固体中CaSO42H2O和CaCO3的质量比x:y,空气的中的水蒸气和二氧化碳对实验结果存在干扰。装置A的作用是吸收空气中的水蒸气和二氧化碳;
(2)若无装置E,空气中水蒸气和二氧化碳进入到D中,导致测定的二氧化碳质量偏大,从而导致计算的碳酸钙质量偏大,则实验测定结果将偏小;
若选用上述的b、c两个数据组合也可求出x:y的值,这是因为装置C实验后增重m3g,说明结晶水的质量是m3g,可以计算出CaSO42H2O的质量,从而可以计算出反应生成的硫酸钙质量,根据反应后玻璃管中固体的质量为m2g(硫酸钙和氧化钙的质量和),进一步可以计算出氧化钙质量,从而可以计算出碳酸钙质量,即可以计算求出x:y的值。还可选用上述的b、c两个数据组合也可求出x:y的值;
(3)有同学提出为了使得到的数据准确,在B中反应结束后的操作很重要,该操作是继续通入空气一段时间,使反应生成的水蒸气、二氧化碳被完全吸收;
(实验二)
(1)分离所得的CaSO42H2O含有CaCO3,可用盐酸除去,这是因为盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)3.44gCaSO42H2O中硫酸钙质量=![]() ,结晶水质量=3.44g﹣2.72g=0.72g,在G点,CaSO42H2O失去结晶水质量为:3.44g﹣3.08g=0.36g,固体中硫酸钙和水的微观粒子个数比为:
,结晶水质量=3.44g﹣2.72g=0.72g,在G点,CaSO42H2O失去结晶水质量为:3.44g﹣3.08g=0.36g,固体中硫酸钙和水的微观粒子个数比为:![]() ,G点固体的化学式是CaSO4H2O。
,G点固体的化学式是CaSO4H2O。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案