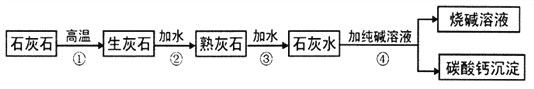
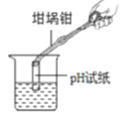
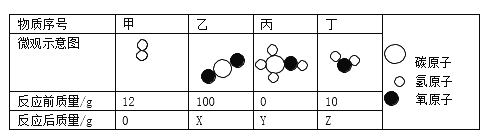
题目内容
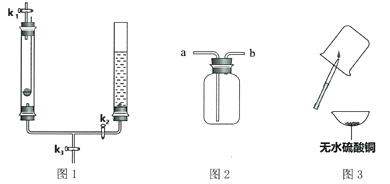
【题目】某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计如图所示实验。依据实验流程回答相关问题。
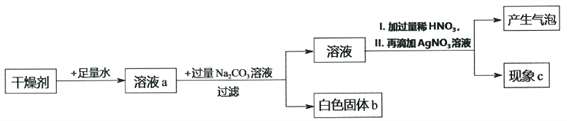
(1)溶液a一定显________性。
(2)白色固体b一定是________(填化学式)。写出可能生成白色固体的化学方程式_______________________________________________(任写一种)。
(3)加入过量的稀HNO3的目的是____________________________________________。
(4)现象c:①若无白色沉淀,干燥剂成分为____________________________________。
②若有白色沉淀,写出产生此现象的化学方程式____________________________________。干燥剂成分为____________________________________。
(5)稀HNO3溶液能否用稀HCl溶液替代_________________(填“能”或“不能”)。
【答案】 碱 CaCO3 Ca(OH)2 + Na2CO3 → CaCO3↓+ 2NaOH或CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl 完全除去NaOH、Na2CO3,以免干扰检验CaCl2 CaO和NaOH NaCl + AgNO3 → AgCl↓ + NaNO3 CaO、CaCl2或NaOH、CaCl2 不能
【解析】(1)CaO、NaOH和CaCl2中的任意两种物质溶于水时,氧化钙与水反应生成氢氧化钙显碱性,氢氧化钠显碱性,故溶液一定显碱性;
(2)CaO、NaOH和CaCl2中的任意两种水溶液中一定含有钙离子,故加入碳酸钠后生成的沉淀是碳酸钙,化学式为CaCO3;氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠反应方程式为Ca(OH)2 + Na2CO3 → CaCO3↓+ 2NaOH,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,反应方程式为CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl;
(3)加入过量的稀硝酸是为了除去氢氧化钠和过量的碳酸钠;
(4)现象c:①若无白色沉淀,说明溶液中没有氯离子,故干燥剂成分为CaO和NaOH ;
②若有白色沉淀,说明溶液中有氯化钙,氯化钙与硝酸银反应生成氯化银和硝酸钠,反应方程式为NaCl + AgNO3 → AgCl↓ + NaNO3;此干燥剂的成分可能是CaO、CaCl2或NaOH、CaCl2;
(5)稀HNO3溶液不能用稀HCl溶液替代,因为稀盐酸中有氯离子,对实验现象有影响;

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案【题目】被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的双氧水(H2O2),通常情况下均为无色液体。在化学实验开放日,实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容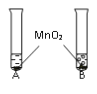
(1)B试管中发生反应的化学方程式:________________________。
(2)如何验证B试管中产生的气体(写出操作步骤、实验现象和结论)?______________________。
实验步骤 | 实验现象 | 实验结论 |
①将等体积的两种无色液体分别加入A、B两个试管中。 ②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象。 | A试管中无明显现象 B试管中有气泡产生 | A试管中的无色液体是: _______________; B试管中的无色液体是:________; |
【题目】为测定某黄铜(铜、锌合金)中铜的质量分数,称取32.5g该黄铜粉末放入烧杯中,再向烧杯内加入200g稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质的质量,测得数据如表:
加入稀硫酸后10分钟 | 加入稀硫酸后20分钟 | 加入稀硫酸后 | 加入稀硫酸后40分钟 | 加入稀硫酸后50分钟 |
232.4g | 232.3g | 232.2g | 232.1g | 232.1g |
(1)完全反应后生成氢气的质量为______g.
(2)计算该黄铜中铜的质量分数为________(写出计算过程).