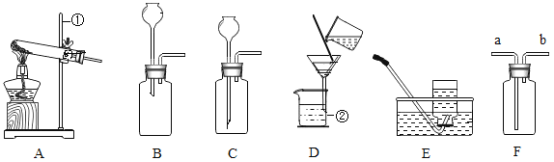
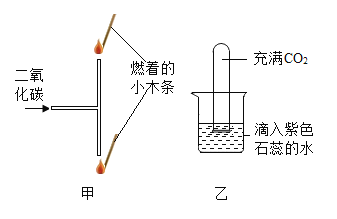
题目内容
【题目】某同学设计实验方案,测定某硫酸废液中硫酸的质量分数。先取一洁净小烧杯,称其质量为18.2g,往其中倒入少量硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为43.9g。请回答下列问题:
(1)产生气体的质量为 g.
(2)计算该废液中硫酸的质量分数(计算结果保留一位小数)。
(3)若铁钉的铁锈(主要成分为氧化铁)未除净,对计算结果的影响是 (填“偏大”“偏小”或“无影响”),原因是 。
【答案】(1)0.1g;
(2)32.7%
(3)偏小
(4)铁锈能消耗一部分硫酸
【解析】
(1)根据质量守恒定律,化学反应前后,物质的总质量不变,故产生气体的质量为:33.2g+10.8g-43.9g=0.1g;
(2)烧杯中硫酸废液的质量为:33.2g-18.2g=15g
解:设产生0.1g氢气需要铁的质量为x,消耗硫酸的质量为y
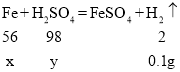
![]() x=2.8g
x=2.8g
![]() y=4.9g
y=4.9g
故铁有剩余,硫酸完全反应,则废液中硫酸的质量分数为:![]() ;
;
(3)由(2)可知,在该实验中,![]() ,铁过量,硫酸不足,故生成氢气的质量由硫酸决定,铁锈未除净,氧化铁会与硫酸反应生成硫酸铁和水,消耗一部分硫酸,使得生成氢气的质量减小,故根据氢气质量求出的硫酸质量偏小,导致硫酸的质量分数偏小,故填:偏小,铁锈能消耗一部分硫酸。
,铁过量,硫酸不足,故生成氢气的质量由硫酸决定,铁锈未除净,氧化铁会与硫酸反应生成硫酸铁和水,消耗一部分硫酸,使得生成氢气的质量减小,故根据氢气质量求出的硫酸质量偏小,导致硫酸的质量分数偏小,故填:偏小,铁锈能消耗一部分硫酸。

【题目】某校化学兴趣小组在查阅资料时发现:可燃物燃烧需要的最低氧含量数据如下表。
可燃物名称 | 蜡烛 | 木炭 | 棉花 | 红磷 | 白磷 |
最低氧含量/% | 16 | 14 | 8 | 8.8 | 3.2 |
请结合数据回答下列问题:
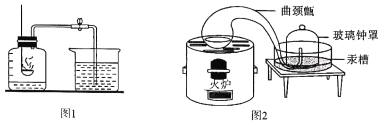
(1)图1为教材中测量空气中氧气体积分数的实验装置图,请写出集气瓶中发生的化学反应程式:___________。结合数据,你认为红磷适合于测量空气中氧气的体积分数吗?并说明你的理由:_________。但实验过程中又确实看到进来的水的体积约占集气瓶内容积的1/5,其原因可能是________。
(2)图2是拉瓦锡的实验装置,回看拉瓦锡的实验,选择汞的优点有_________(填序号,多选)。
A 实验过程没有污染
B 生成的化合物加热分解后又得到汞和氧气
C 在汞槽中起到液封作用
D 能将密闭装置内空气中的氧气几乎耗尽
【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
【提出问题】①三种溶液的酸碱性?
②它们与酸反应时溶液的pH如何变化?
【查阅资料】
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
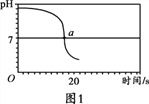
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。

【解释与结论】
(1)实验1得出三种溶液的碱性由强到弱的顺序为________________。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是_________,实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是_________。
(3)实验3中,b点的溶质为_________,c点后发生反应的化学方程式为_________。
(4)依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为_________。