题目内容
【题目】电池是日常必备用品之一,但它也是环境污染的一个重要来源。下面是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
(知识储备)
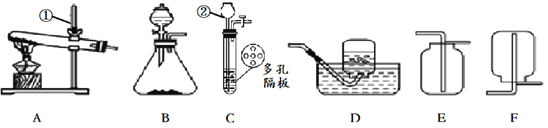
(1)锌锰电池的构造和组成(见图)。

(2)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾晶体(CuSO4 5H2O)受热时可失去结晶水变为白色的无水硫酸铜粉末(CuSO4)。
I.制备皓矾晶体(ZnSO4xH2O)
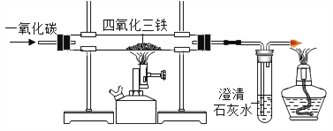
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如图:

(1)流程图中试剂a的化学式是________;得到的滤液1农业上可用作_______________。
(2)将滤渣B在空气中充分灼烧可提纯制得的固体是_________,该方法提纯的原理是(用化学方程式回答)______________________。
(3)测定锌皮(铜芯)中锌的质量分数:称取不同质量锌皮(铜芯)于烧杯中,并加入等浓度的稀硫酸,数据如下表所示:
锌皮(铜芯)的质量 | 20g | 15g |
稀硫酸的质量 | 100g | 120 g |
生成气体的质量 | 0.4 g | 0.4 g |
求:锌皮(铜芯)中锌的质量分数。(写出计算过程,答案保留一位小数)_______
(4)滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系如下表,
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
将滤液2蒸发浓缩、_____________、过滤、洗涤、干燥,可得到皓矾晶体(ZnSO4xH2O)。
小组同学将部分皓矾晶体(ZnSO4xH2O)带回实验室,用如图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:

(ZnSO4xH2O ==== ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
(5) A中的化学方程式是______________,B中的试剂可从下列物质中选取,你的选择是________。
A.浓硫酸 B.硝酸银溶液 C.饱和碳酸钠溶液 D.澄清石灰水
(6)实验过程中若不通入空气测得的结果将____________
(填“偏大”、 “偏小”或“无影响”)。根据实验结果,计算皓矾晶体中结晶水的x值为_____。
(7)将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如右图,写出C-D
段发生反应的化学方程式____________________。

【答案】 H2O 氮肥 二氧化锰 C + O2 ![]() CO2 86.7% 降温结晶(冷却热饱和溶液) CO2 + 2NaOH = Na2CO3+H2O A 偏小 7 ZnSO4
CO2 86.7% 降温结晶(冷却热饱和溶液) CO2 + 2NaOH = Na2CO3+H2O A 偏小 7 ZnSO4![]() 6H2O
6H2O ![]() ZnSO4
ZnSO4![]() H2O +5H2O
H2O +5H2O
【解析】Ⅰ、(1)根据流程图,滤渣和滤液,可推测试剂a为水;推测滤液1的成分有氯化铵,故可作氮肥;(2)将滤渣B在空气中充分灼烧,可提纯制得的固体是MnO2,该方法提纯的原理是:C+O2![]() CO2;(3)根据表中数据分析得出:15g锌皮与100g稀硫酸恰好完全反应生成0.4g氢气,设参加反应的锌的质量为
CO2;(3)根据表中数据分析得出:15g锌皮与100g稀硫酸恰好完全反应生成0.4g氢气,设参加反应的锌的质量为![]() ,
,
H2SO4+Zn=ZnSO4+H2↑
65 2
![]() 0.4g
0.4g
![]()
![]() =13g
=13g
锌皮(铜芯)中锌的质量分数为:![]() ;(4)将滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系,将滤液2蒸发浓缩、降温结晶,可得到皓矾晶体(ZnSO4xH2O);
;(4)将滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系,将滤液2蒸发浓缩、降温结晶,可得到皓矾晶体(ZnSO4xH2O);
II.(5)A中为二氧化碳与氢氧化钠反应,故反应的化学方程式是CO2 + 2NaOH = Na2CO3+H2O;
实验的目的是测定皓矾中结晶水的含量所以不使水蒸气随二氧化碳进入碱石灰中,所以B中的试剂具有吸水性,题中四中物质中只有A浓硫酸具有吸水性;(6)实验过程中若不通入CO2,则最后称量玻璃管中固体偏重,所以所得中结晶水的质量偏小,使测定的结果偏小;28.7g皓矾晶体中结晶水的质量为28.7g16.1g=12.6g,ZnSO4xH2O中结晶水的质量分数为![]() ,解得x=7;(7)将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如图,D点时固体的质量为17.9g,结晶水的质量为:28.7g-17.9g=10.8g,
,解得x=7;(7)将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如图,D点时固体的质量为17.9g,结晶水的质量为:28.7g-17.9g=10.8g,![]() ,x=6,故CD段发生反应的化学方程式ZnSO46H2O═ZnSO4+6H2O。
,x=6,故CD段发生反应的化学方程式ZnSO46H2O═ZnSO4+6H2O。

 阅读快车系列答案
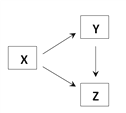
阅读快车系列答案【题目】通过一步化学反应实现如图所示的X、Y、Z三种物质间转化,表格中X、Y、Z对应的物质不能实现这种转化的是
X | Y | Z | |
A | CO2 | Na2CO3 | CaCO3 |
B | NaNO3 | Na2CO3 | NaCl |
C | HCl | BaCl2 | NaCl |
D | Mg | MgO | MgCl2 |
A. A B. B C. C D. D