题目内容
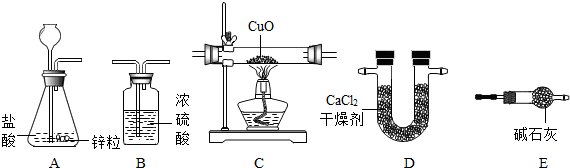
利用干燥而纯净的氢气还原灼热氧化铜的实验测定水的质量组成,其装置如图所示.反应后其实验测定的数据如下表所列.
试回答:
(1)装置B中金属和酸反应制取氢气,最好选择下列哪一组
A、铜和浓硫酸 B、锌和稀硫酸 C、镁和浓盐酸 D、铁和稀硝酸
(2)装置正确的连接顺序(自左向右)是(填字母)
(3)装置A的作用是
(4)根据实验数据计算填空:
水中氢、氧两元素的质量比为
(5)本次实验测定的结果和理论上水中氢、氧两元素的质量比相比较是(填“偏高”、“偏低”或“恰好相符”)
A、装置C开始加热的时候没有用氢气赶尽装置中的空气
B、实验前装置D称量后再连接然后开始实验导致的必然结果
C、实验后称量装置D的质量时动作太慢,吸收了空气中的水蒸汽
D、托盘天平的精确度不高,有误差
E、实验后没有继续通入氢气直到冷却,就开始称量装置D的质量,
导致热铜与空气中的氧气反应
F、氧化铜没有完全反应,反应后装置C中还有氧化铜
(6)依据(5)的结论回答问题
用锌、氧化铜、稀硫酸为原料制取单质铜,有下列两种途径:
(1)Zn
H2
Cu
(2)CuO
CuSO4
Cu
当实验室用这两种途径制得相同质量的铜时,下列叙述符合实际实验结果的是(
A、消耗相同质量的氧化铜 B、消耗相同质量的锌
C、消耗相同质量的硫酸 D、生成硫酸锌的质量可能相同.

| 实验前 | 实验后 | |
| (氧化铜+玻璃管)的质量/g | 150.5 | 144.1 |
| (氯化钙+U型管)的重量/g | 210.8 | 218.2 |
(1)装置B中金属和酸反应制取氢气,最好选择下列哪一组
B
B
.A、铜和浓硫酸 B、锌和稀硫酸 C、镁和浓盐酸 D、铁和稀硝酸
(2)装置正确的连接顺序(自左向右)是(填字母)
B、A、C、D
B、A、C、D
.(3)装置A的作用是
除去氢气中混有的水蒸汽
除去氢气中混有的水蒸汽
.(4)根据实验数据计算填空:
水中氢、氧两元素的质量比为
5:32
5:32
.(化成最简整数比)(5)本次实验测定的结果和理论上水中氢、氧两元素的质量比相比较是(填“偏高”、“偏低”或“恰好相符”)
偏高
偏高
,导致这样结果的原因可能是A、B、C、D、E
A、B、C、D、E
(填字母).A、装置C开始加热的时候没有用氢气赶尽装置中的空气
B、实验前装置D称量后再连接然后开始实验导致的必然结果
C、实验后称量装置D的质量时动作太慢,吸收了空气中的水蒸汽
D、托盘天平的精确度不高,有误差
E、实验后没有继续通入氢气直到冷却,就开始称量装置D的质量,
导致热铜与空气中的氧气反应
F、氧化铜没有完全反应,反应后装置C中还有氧化铜
(6)依据(5)的结论回答问题
用锌、氧化铜、稀硫酸为原料制取单质铜,有下列两种途径:
(1)Zn
| +H2SO4 |
| +CuO |
(2)CuO
| +H2SO4 |
| +Zn |
当实验室用这两种途径制得相同质量的铜时,下列叙述符合实际实验结果的是(
A
A
)A、消耗相同质量的氧化铜 B、消耗相同质量的锌
C、消耗相同质量的硫酸 D、生成硫酸锌的质量可能相同.
分析:(1)根据金属和酸的性质进行解答;
(2)根据用锌和稀硫酸制取氢气以及得到干燥而纯净的氢气需要经过除去氢气中的水蒸气进行解答;
(3)根据浓硫酸具有吸水性进行解答;
(4)根据C装置中减少的质量就是生成水中氧元素的质量以及D中增加的质量为水的质量可求水中氢、氧两元素的质量比进行解答;
(5)根据水的化学式为H2O可知理论上水中氢、氧两元素的质量比进行解答;
(6)利用两种途径的过程,书写相应的化学方程式,根据反应的物质之间量的关系进行判断,从氢气还原氧化铜,氢气必须过量,所以要使用更多锌更多硫酸,制取相同质量的铜,铜只来源于氧化铜,所以消耗的氧化铜质量相等,利用这些关系解决此题.
(2)根据用锌和稀硫酸制取氢气以及得到干燥而纯净的氢气需要经过除去氢气中的水蒸气进行解答;
(3)根据浓硫酸具有吸水性进行解答;
(4)根据C装置中减少的质量就是生成水中氧元素的质量以及D中增加的质量为水的质量可求水中氢、氧两元素的质量比进行解答;
(5)根据水的化学式为H2O可知理论上水中氢、氧两元素的质量比进行解答;
(6)利用两种途径的过程,书写相应的化学方程式,根据反应的物质之间量的关系进行判断,从氢气还原氧化铜,氢气必须过量,所以要使用更多锌更多硫酸,制取相同质量的铜,铜只来源于氧化铜,所以消耗的氧化铜质量相等,利用这些关系解决此题.
解答:解:(1)A、铜和浓硫酸反应生成硫酸铜、二氧化硫和水,不生成氢气,故错误;B、锌和稀硫酸反应生成硫酸锌和氢气,故正确;C、浓盐酸具有挥发性,会挥发出氯化氢气体,使收集到的气体不纯,故错误;D、铁和稀硝酸反应生成硝酸铁、二氧化氮和水,而不是氢气,故错误;故填:B;
(2)用锌和稀硫酸制取氢气,应在B装置内进行,要得到干燥而纯净的氢气需要经过除去氢气中的水蒸气,所以要经过A装置,得到的干燥氢气经过C还原氧化铜,生成的水被D装置吸收.所以装置正确的连接顺序B、A、C、D;故填:B、A、C、D;
(3)浓硫酸具有吸水性,所以装置A的作用是除去氢气中混有的水蒸汽;故填:除去氢气中混有的水蒸汽;
(4)C装置中减少的质量就是生成水中氧元素的质量,D中增加的质量为水的质量,所以氧元素的质量=150.5g-144.1g=6.4g,氢元素的质量=218.2g-210.8g-6.4g=1g,所以水中氢、氧两元素的质量比=1g:6.4g=5:32;故填:5:32;
(5)水的化学式为H2O可知理论上水中氢、氧两元素的质量比=(1×2):16=1:8,所以本次实验测定的结果和理论上水中氢、氧两元素的质量比相比较是偏高,偏大有两种可能,①H的质量增大;②O的质量减小;
通过实验图,还有一点要明白,O的质量是通过C中减少的质量来求算的,H的质量是通过D-D来求算的.
A、装置C开始加热的时候没有用氢气赶尽装置中的空气,空气中有水蒸气,所以会使水的质量增加,也就使氢元素的质量增加,故正确;
B、实验前装置D称量后再连接然后开始实验导致的必然结果,吸收了空气中的水蒸汽,也就使氢元素的质量增加,故正确;
C、实验后称量装置D的质量时动作太慢,吸收了空气中的水蒸汽,也就使氢元素的质量增加,故正确;
D、托盘天平的精确度不高,有误差,也可能导致结果偏大,故正确;
E、实验后没有继续通入氢气直到冷却,就开始称量装置D的质量,导致热铜与空气中的氧气反应,会使得氧元素的质量减少,故正确;
F、氧化铜没有完全反应,反应后装置C中还有氧化铜,不影响实验结果,故错误;
故填:偏高;ABCDE;
(6)①Zn+H2SO4=ZnSO4+H2↑,H2+CuO
H2O+Cu 生成1份Cu需要1份CuO和1份H2SO4和1份Zn;
②CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=Cu+ZnSO4 生成1份Cu需要1份CuO和1份H2SO4和1份Zn;
A、因为整个制备过程中,所有Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同,故A正确;
B、这两种方法制得等量的铜,看上去都是相同的.特别注意用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Zn的量也要多一些,故B错误;
C、H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Zn的量也要多一些,故C错误;
D、H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Zn的量也要多一些,同时生成的硫酸锌质量不同,故D错误.
故选:A.
(2)用锌和稀硫酸制取氢气,应在B装置内进行,要得到干燥而纯净的氢气需要经过除去氢气中的水蒸气,所以要经过A装置,得到的干燥氢气经过C还原氧化铜,生成的水被D装置吸收.所以装置正确的连接顺序B、A、C、D;故填:B、A、C、D;
(3)浓硫酸具有吸水性,所以装置A的作用是除去氢气中混有的水蒸汽;故填:除去氢气中混有的水蒸汽;
(4)C装置中减少的质量就是生成水中氧元素的质量,D中增加的质量为水的质量,所以氧元素的质量=150.5g-144.1g=6.4g,氢元素的质量=218.2g-210.8g-6.4g=1g,所以水中氢、氧两元素的质量比=1g:6.4g=5:32;故填:5:32;
(5)水的化学式为H2O可知理论上水中氢、氧两元素的质量比=(1×2):16=1:8,所以本次实验测定的结果和理论上水中氢、氧两元素的质量比相比较是偏高,偏大有两种可能,①H的质量增大;②O的质量减小;
通过实验图,还有一点要明白,O的质量是通过C中减少的质量来求算的,H的质量是通过D-D来求算的.
A、装置C开始加热的时候没有用氢气赶尽装置中的空气,空气中有水蒸气,所以会使水的质量增加,也就使氢元素的质量增加,故正确;
B、实验前装置D称量后再连接然后开始实验导致的必然结果,吸收了空气中的水蒸汽,也就使氢元素的质量增加,故正确;
C、实验后称量装置D的质量时动作太慢,吸收了空气中的水蒸汽,也就使氢元素的质量增加,故正确;
D、托盘天平的精确度不高,有误差,也可能导致结果偏大,故正确;
E、实验后没有继续通入氢气直到冷却,就开始称量装置D的质量,导致热铜与空气中的氧气反应,会使得氧元素的质量减少,故正确;
F、氧化铜没有完全反应,反应后装置C中还有氧化铜,不影响实验结果,故错误;
故填:偏高;ABCDE;
(6)①Zn+H2SO4=ZnSO4+H2↑,H2+CuO
| ||
②CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=Cu+ZnSO4 生成1份Cu需要1份CuO和1份H2SO4和1份Zn;
A、因为整个制备过程中,所有Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同,故A正确;
B、这两种方法制得等量的铜,看上去都是相同的.特别注意用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Zn的量也要多一些,故B错误;
C、H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Zn的量也要多一些,故C错误;
D、H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Zn的量也要多一些,同时生成的硫酸锌质量不同,故D错误.
故选:A.
点评:典型的实验探究题,熟练掌握氢气还原氧化铜的性质和实验才能准确解答该题,要分析清楚每步实验的目的即可准确解答该题.

练习册系列答案
相关题目
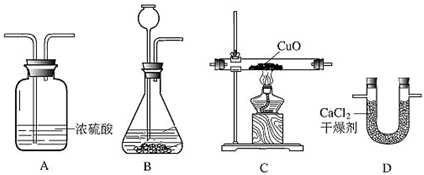
(6分)利用干燥而纯净的氢气还原氧化铜的实验测定水的质量组成,装置如下图:

装置的连接顺序为ABCDE,完全反应后,其实验测定的数据如下表所列:
|
|
实验前 |
实验后 |
|
|
C(氧化铜+玻璃管)的质量/g |
75.6 |
69.2 |
O元素的质量6.4g |
|
D(氯化钙+U型管)的质量/g |
110.8 |
118.0 |
H2O的质量 7.2g |
试回答:
(1)装置A中发生反应的化学方程式为 ,装置B的作用是 。
(2)装置C中的现象为 。
(3)根据实验数据填空:水中氢、氧两种元素的质量比为 。
(4)装置E中碱石灰能吸收水蒸气,若不安装E装置,会使结果中氢元素的质量 ,(填“偏大”“偏小”“不受影响”之一)试简述判断依据 。
利用干燥而纯净的氢气还原氧化铜的实验测定水的质量组成,装置如图:装置的连接顺序为ABCDE,完全反应后,其实验测定的数据如下表所列:

| 实验前 | 实验后 | ||
| C(氧化铜+玻璃管)的质量/g | 75.6 | 69.2 | O元素的质量6.4g |
| D(氯化钙+U型管)的质量/g | 110.8 | 118.0 | H2O的质量 7.2g |
(1)装置A中发生反应的化学方程式为________,装置B的作用是________.
(2)装置C中的现象为________.
(3)根据实验数据填空:水中氢、氧两种元素的质量比为________.
(4)装置E中碱石灰能吸收水蒸气,若不安装E装置,会使结果中氢元素的质量________,(填“偏大”“偏小”“不受影响”之一)试简述判断依据________.