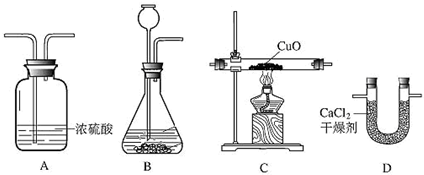
题目内容
利用干燥而纯净的氢气还原氧化铜的实验测定水的质量组成,装置如图:装置的连接顺序为ABCDE,完全反应后,其实验测定的数据如下表所列:
| 实验前 | 实验后 | ||
| C(氧化铜+玻璃管)的质量/g | 75.6 | 69.2 | O元素的质量6.4g |
| D(氯化钙+U型管)的质量/g | 110.8 | 118.0 | H2O的质量 7.2g |
(1)装置A中发生反应的化学方程式为________,装置B的作用是________.
(2)装置C中的现象为________.
(3)根据实验数据填空:水中氢、氧两种元素的质量比为________.
(4)装置E中碱石灰能吸收水蒸气,若不安装E装置,会使结果中氢元素的质量________,(填“偏大”“偏小”“不受影响”之一)试简述判断依据________.
解:(1)锌粒与稀盐酸反应生成氢气和氯化锌,发生反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;B装置是干燥氢气,除去氢气中的水蒸气;
(2)装置C中是氢气还原氧化铜,现象为黑色粉末逐渐变为红色;
(3)C装置减轻的质量就是CuO中的O失去的质量,是氢气夺走了CuO中的O生成了水,U形管增重的质量就是该反应生成的水的质量,则水中H元素的质量就是水的质量减去O元素的质量,故氧元素质量为:75.6 g-69.2 g=6.4g,生成水的质量为:118.0 g-110.8 g=7.2g;生成水中氢元素的质量为 7.2 g-6.4 g=0.8g;则水中氢跟氧的质量比就是:[(108.0g-100.8g)-(65.6g-59.2g)]:(65.6g-59.2g)=1:8;
(4)装置E中碱石灰能吸收水蒸气,若不安装E装置,空气中的水蒸气会进入D装置,使测得水的质量增大导致计算出H元素的质量增大,所以会使结果中氢元素的质量偏大.
故答案为:(1)Zn+2HCl═ZnCl2+H2↑;吸收A中会发出的水蒸气;
(2)黑色粉末逐渐变为红色;
(3)1:8;
(4)偏大; 空气中的水蒸气会进入D装置,使测得水的质量增大导致计算出H元素的质量增大.
分析:由题意可知,氢气需纯净,可通过E装置除去氯化氢,制取干燥的氢气需要除掉反应中带出的水蒸气,实验终须测生成水的质量,所以需要把还原氧化铜生成的水吸收并称重.连接过程中还要考虑洗气的通入顺序,一般规律是:液体洗气装置的通入顺序是长进短出;C装置减轻的质量就是生成的水中氧元素的质量,U形管增重即生成的水的质量.
点评:利用液体除杂质过程中要长导管进、短导管出,即“长进短出”;测定水的组成需要确切的实验数据,所以要分析清楚每步实验的目的方可准确解答该题,培养了学生对化学知识的综合运用能力.
(2)装置C中是氢气还原氧化铜,现象为黑色粉末逐渐变为红色;
(3)C装置减轻的质量就是CuO中的O失去的质量,是氢气夺走了CuO中的O生成了水,U形管增重的质量就是该反应生成的水的质量,则水中H元素的质量就是水的质量减去O元素的质量,故氧元素质量为:75.6 g-69.2 g=6.4g,生成水的质量为:118.0 g-110.8 g=7.2g;生成水中氢元素的质量为 7.2 g-6.4 g=0.8g;则水中氢跟氧的质量比就是:[(108.0g-100.8g)-(65.6g-59.2g)]:(65.6g-59.2g)=1:8;
(4)装置E中碱石灰能吸收水蒸气,若不安装E装置,空气中的水蒸气会进入D装置,使测得水的质量增大导致计算出H元素的质量增大,所以会使结果中氢元素的质量偏大.
故答案为:(1)Zn+2HCl═ZnCl2+H2↑;吸收A中会发出的水蒸气;
(2)黑色粉末逐渐变为红色;
(3)1:8;
(4)偏大; 空气中的水蒸气会进入D装置,使测得水的质量增大导致计算出H元素的质量增大.
分析:由题意可知,氢气需纯净,可通过E装置除去氯化氢,制取干燥的氢气需要除掉反应中带出的水蒸气,实验终须测生成水的质量,所以需要把还原氧化铜生成的水吸收并称重.连接过程中还要考虑洗气的通入顺序,一般规律是:液体洗气装置的通入顺序是长进短出;C装置减轻的质量就是生成的水中氧元素的质量,U形管增重即生成的水的质量.
点评:利用液体除杂质过程中要长导管进、短导管出,即“长进短出”;测定水的组成需要确切的实验数据,所以要分析清楚每步实验的目的方可准确解答该题,培养了学生对化学知识的综合运用能力.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
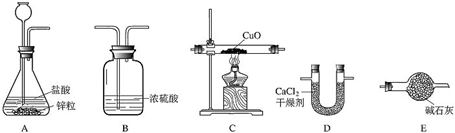
(6分)利用干燥而纯净的氢气还原氧化铜的实验测定水的质量组成,装置如下图:

装置的连接顺序为ABCDE,完全反应后,其实验测定的数据如下表所列:
|
|
实验前 |
实验后 |
|
|
C(氧化铜+玻璃管)的质量/g |
75.6 |
69.2 |
O元素的质量6.4g |
|
D(氯化钙+U型管)的质量/g |
110.8 |
118.0 |
H2O的质量 7.2g |
试回答:
(1)装置A中发生反应的化学方程式为 ,装置B的作用是 。
(2)装置C中的现象为 。
(3)根据实验数据填空:水中氢、氧两种元素的质量比为 。
(4)装置E中碱石灰能吸收水蒸气,若不安装E装置,会使结果中氢元素的质量 ,(填“偏大”“偏小”“不受影响”之一)试简述判断依据 。