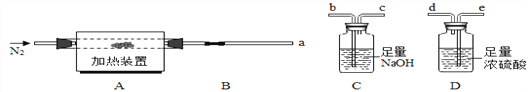
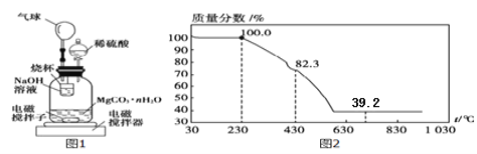
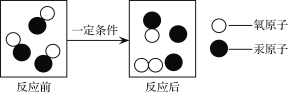
题目内容
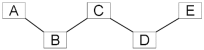
【题目】下图中A、B、C、D是四种常见的物质。其中,A是胃酸的主要成分,B为最轻的气体,C属于盐类,是用小苏打治疗胃酸过多症时发生反应的生成物之一,D的溶液呈黄色。
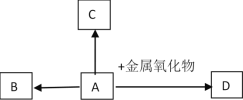
(1)C物质的化学式是__________。
(2)写出符合下列转化的化学反应方程式:
A→B:____________________________(只写一个)
A→D:_______________________________________。
【答案】 NaCl Fe+2HCl=FeCl2+H2↑ Fe2O3+6HCl=FeCl3+3H2O
【解析】
A是胃酸的主要成分,则A是HCl,B为最轻的气体,则B是H2,C属于盐类,是用小苏打治疗胃酸过多症时发生反应的生成物之一,则C是NaCl,D的溶液呈黄色,则D溶液的溶质是FeCl3;
(1)C物质的化学式是NaCl;
(2)稀盐酸与铁反应生成氯化亚铁和氢气,反应方程式为Fe+2HCl=FeCl2+H2↑;D溶液中的溶质是FeCl3,故金属氧化物是Fe2O3,Fe2O3与稀盐酸反应生成氯化铁和水,反应方程式为Fe2O3+6HCl=FeCl3+3H2O。

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目