题目内容
【题目】碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)是一种新型吸波隐形材料中的增强剂。
(查阅资料)(1) MgCO3·nH2O微溶于水;
(2) MgCO3·nH2O在230℃时开始失去结晶水, 400℃以上时开始分解生成三种氧化物。
I.合成碳酸镁晶须
步骤:①配制一定溶度的MgSO4溶液和NH4HCO3溶液;②量取一定量的NH4HCO3溶液于容器中,搅拌并逐滴加入MgSO4溶液,控制温度50℃,反应一段时间;③用氨水调节溶液pH至9.5,放置1h后,过滤、洗涤、干燥得碳酸镁晶须产品。
(1)步骤①配制一定溶质质量分数的MgSO4溶液所需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、______________;
(2)步骤②反应的温度控制在50℃,较好的加热方法是__________;
(3)氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________;
(4)检验沉淀已洗涤干净的方法是:取最后一次洗涤的滤液,滴入_________,若无沉淀说明已洗涤干净。
(5)干燥得碳酸镁晶须产品温度不能过高,目的是______________。
II.测定产品MgCO3.nH2O中的n值
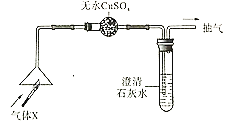
(方案一)将碳酸镁晶须放入A装置中加热(仪器和装置如下图所示),回答下列问题:
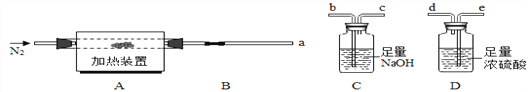
(6)上述装置的连接顺序为_____(按气流方向,用接口字母表示),其中B处的长玻璃导管的作用是__________,C装置的作用是__________。
(7)加热前先通入N2排尽装置中的空气,然后称取C、D的初始质量。再次连接好装置,边加热边通入N2,此时通入N2的作用是_____________。
(8)若B装置中无残留物。装置C反应前后质量差为m1,装置D反应前后质量差m2 。根据以上实验数据,确测定n值, n=___(用含m1、m2的代数式表示)。
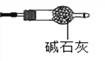
(9)有同学提出上述连接好的装置仍不够完善。需要在D装置的后面连接下图装置,目的是________________,否则测得n值会________(“偏大”、“偏小”、“无影响”) 。
(方案二)
称量100g碳酸镁晶须放入如下图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被过量NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后,烧杯中的溶液加入已知浓度的盐酸恰好完全反应,测得CO2的总量;重复上述操作2次。
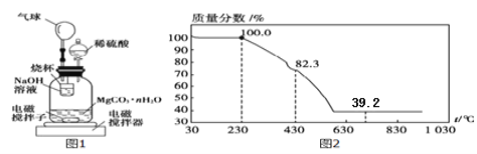
(10)氢氧化钠吸收二氧化碳的化学反应方程式____________________;
(11)图中气球的作用是__________________;
(12)上述反应后期要升温到30℃,主要目的是______________;
(13)设3次实验测得每100 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为ag,则n值为_______(用含a的代数式表示);
(14)称取100g上述晶须产品进行热重分析,热重曲线如图2,则该条件下合成的晶须中,n=_______(写出过程)。
【答案】量筒水浴加热(NH4)2SO4 BaCl2溶液防止晶体失去结晶水a→e→d→b→c冷却气体吸收二氧化碳气体生成的二氧化碳和水完全被C、D装置吸收、防止倒吸22m2/9m1 防止空气中的二氧化碳进入C装置,影响实验结果偏小2NaOH+CO2=Na2CO3+H2O 缓冲作用使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收(4400-84a)/18a 1
【解析】
(1)根据配制溶液步骤:计算、称量、溶解、转移等,需要的仪器有:托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管等,其中玻璃仪器为:烧杯、量筒、玻璃棒、胶头滴管;
(2)加热温度低于100℃需要水浴加热控制温度;
(3)氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3nH2O沉淀外,还生成硫酸铵;
(4)检验沉淀已洗涤干净的方法是取最后一次洗涤的滤出液少许,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净,若有沉淀则说明未洗涤干净;
(5)由于碳酸镁晶须高温会失去结晶水,所以干燥得碳酸镁晶须产品温度不能过高;
(6)上述装置的连接顺序为:应该首先通过D装置吸收水蒸气,后通过C装置吸收二氧化碳;将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体,故其连接顺序是a→e→d→b→c;装置C的作用是吸收反应生成的二氧化碳气体,装置D的作用是吸收水蒸气,装置B是长玻璃管起到冷却作用;
(7)因为加热后的装置中含有残留的HCl和水蒸气,为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸;
(8)若B装置中无残留物,通过装置D吸收的质量为生成水的质量,装置C吸收的是分解生成的二氧化碳的质量,可以计算,![]() =1:n,n=
=1:n,n= ![]() ;
;
(9)防止空气中的二氧化碳进入C装置,使m1偏大,测得n值会偏小,所以需要在D装置的后面连接装有碱石灰的干燥管;
(10)氢氧化钠与二氧化碳反应生成碳酸钠和水,化学反应方程式为:2NaOH+CO2=Na2CO3+H2O;
(11)气球的作用是缓冲装置中的压强作用;
(12)要使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收,上述反应后期要升温到30℃;
(13)实验测得每100g碳酸镁晶须产生的CO2平均值为a g,依据化学方程式可知,碳酸镁物质的质量为![]() g,根据化学式可知,MgCO3nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=
g,根据化学式可知,MgCO3nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=![]() :
:![]() ,得到n=
,得到n=![]() ;
;
(14)MgCO3nH2O n=1~5,分析图象430°C剩余质量为82.3g,为失去结晶水的质量,剩余质量为39.2g是碳酸镁分解失去二氧化碳的质量,得到100g×![]() =100g-82.3g,解得:n=1。
=100g-82.3g,解得:n=1。

【题目】某研究小组为探究影响铁制品锈蚀及快慢的因素,设计了如下两个实验,依据实验回答下列问题。(已知:氯化钙可作干燥剂;稀氨水呈碱性)
实验一:探究铁制品生锈的条件
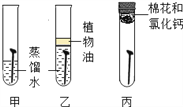
实验二:探究影响铁制品锈蚀快慢的因素(稀氨水和稀醋酸的质量分数相同)
| 实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 | |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 | |
出现铁锈 所需时间 | 1天 未见锈蚀 | 5分钟 | 1天 未见锈蚀 | 1分钟 |
(1)实验一的乙中植物油的作用是____。
(2)由实验一探究铁制品生锈结果可知铁锈中含有的元素是____。
(3)实验②和④可探究_____因素对铁制品锈蚀快慢的因素;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是_____(填实验序号)。
(4)由实验二表中实验现象得出的结论是______ 。
【题目】从微观的角度了解物质及其变化,有助于更好地认识物质的组成和变化的本质。
(1)下表为部分元素的原子结构示意图
元素名称 | 氢 | 氦 | 氧 | 氟 | 钠 | 硫 |
元素符号 | H | He | O | F | Na | S |
原子结构示意图 |
|
|
|
|
|
|
①表中氧原子的核电荷数x=_____
②元素在周期表中的周期序数等于该元素原子具有的电子层数。上表所列的6种元素中,位于第一周期的元素有_____种。
③氟原子得到一个电子所形成离子的离子符号为_____。
④由上表中两种元素组成的一种化合物排放到空气中会形成酸雨,该化合物为_____。
(2)如图为金属钠与水反应的示意图
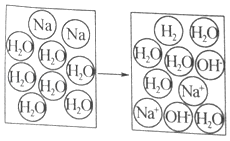
①保持水的化学性质的最小粒子是_____。
②写出该反应的化学方程式:_____。