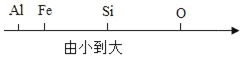
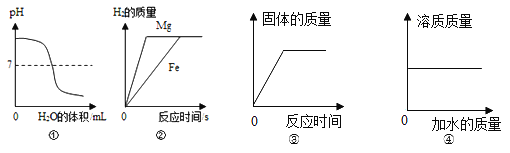
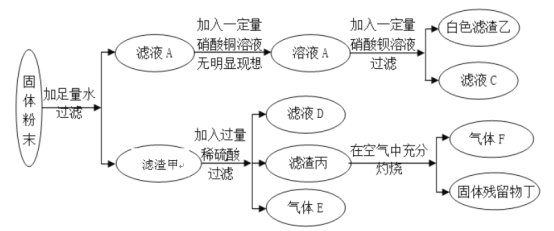
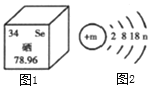
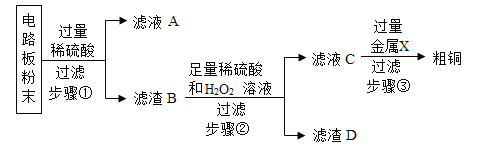
题目内容
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有Sn、Fe、Cu、Au、Ag等金属。如图是某工厂回收其中部分金属的流程图。(假设流程图中各反应均恰好完全反应。已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是_____;步骤②~⑤都涉及到的操作是_____,其中用到的金属仪器是_____。滤渣1中含有的金属是_____(选填字母)。
A Cu、Sn、Au B Cu、Au、Ag C Au、Ag D Cu、Sn、Au、Ag
(2)已知Sn的化合价为+2价,则步骤③反应的化学方程式为_____。步骤⑤的现象为_____。
(3)步骤⑥回收的纯净物B是_____(写名称)。
【答案】H2 过滤 铁架台 B SnSO4+Fe═FeSO4+Sn 有红色固体生成,溶液由蓝色变为浅绿色 硫酸亚铁
【解析】
(1)某种手机电路板中含有Sn、Fe、Cu、Au、Ag等金属,其中Fe可与稀硫酸反应生成氢气,所以步骤②中产生的气体是H2。提过滤可将难溶于水的固体物质与液体分离,步骤②~⑤都是将金属从溶液中分离出来,所以涉及到的操作是过滤,过滤操作中用到的金属仪器是铁架台,滤渣1中含有的金属是不与稀硫酸反应的银、金、铜,故选B;
(2)金属活动性顺序中,铁位于锡的前面,滤液1中含有SnSO4,所以步骤③的反应是硫酸锡和铁反应生成硫酸亚铁和锡,化学方程式为:SnSO4+Fe═FeSO4+Sn,步骤⑤是铁和硫酸铜反应生成硫酸亚铁和铜,所以实验现象为有红色固体生成,溶液由蓝色变为浅绿色;
(3)滤液2和滤液4中含有硫酸亚铁,所以步骤⑥回收的纯净物B是硫酸亚铁。

练习册系列答案
相关题目