题目内容
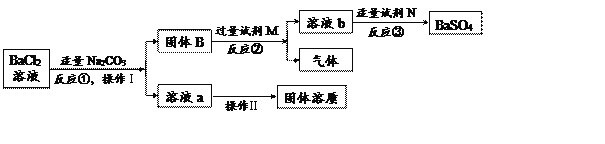
【题目】有一包固体粉末,可能含有镁粉、碳粉、氧化铜、硫酸钾、氢氧化钠中的一种或几种。为探究固体的组成,某化学兴趣小组进行了如图所示实验。
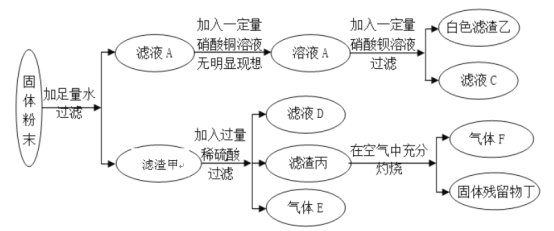
请回答下列问题:
(1)实验中生成白色滤渣乙的化学方程式是__________。
(2)原固体中一定不含有的物质是__________。
(3)原固体中一定含有的物质是__________。
(4)实验结束后,该兴趣小组将滤液C和滤液D都倒入废液缸,有白色沉淀生成,则滤液C中一定含有的溶质是__________。
(5)如果滤渣丙的质量等于固体残留物丁的质量,则气体F与固体残留物丁的质量比为__________。
【答案】 K2SO4+Ba(NO3)2=2KNO3+BaSO4↓ 氢氧化钠 镁粉、碳粉、氧化铜、硫酸钾 硝酸铜、硝酸钾、硝酸钡 11:15
【解析】(1)镁粉、碳粉和氧化铜不溶于水,硫酸钾和氢氧化钠易溶于水,故滤渣中可能有镁粉,氧化铜和碳粉中的一种或几种,滤液中可能有硫酸钾和氢氧化钠中的一种或几种,滤液中加入一定量的硝酸铜后,无沉淀生成,说明原溶液中一定没有氢氧化钠,故原混合物中没有 氢氧化钠,故所得的溶液中可能有硫酸钾,一定有硝酸铜,再加入硝酸钡后,有白色沉淀生成,硝酸钡与硫酸钾反应生成硫酸钡沉淀和硝酸钾,故反应方程式为K2SO4+Ba(NO3)2=2KNO3+BaSO4↓;
(2)向滤渣中加入过量的稀硫酸后,有气泡冒出,一定有镁;滤渣在空气中加强热有气体生成并有固体,说明原混合物中有碳和铜,故原混合物中一定有的是镁、硫酸钾,碳粉和氧化铜;
(3)一定没有的是氢氧化钠;
(4)滤液C中的溶质是硝酸铜和硝酸钾的混合物,可能有硝酸钡,滤液D中的溶质有硫酸镁和稀硫酸,将滤液C和滤液D都倒入废液缸,有白色沉淀生成,说明一定有硝酸钡,则滤液C中一定含有的溶质是硝酸铜、硝酸钾、硝酸钡;
(5)滤渣丙是碳和铜的混合物,滤渣丁是氧化铜,设固体混合物中碳的质量为x,铜的质量为y
C+O2点燃CO2 2Cu+ O2△2CuO
12 44 128 160
x ![]() x y
x y ![]() y
y
有题可知,碳粉与铜的质量等于生成氧化铜的质量
故x+y=![]() y,解得y=4x,气体F与固体残留物丁的质量比为
y,解得y=4x,气体F与固体残留物丁的质量比为![]() x:
x:![]() y=11:15。
y=11:15。

 习题精选系列答案
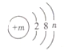
习题精选系列答案【题目】利用下表中的装置进行实验。对该实验分析推理不正确的是( )
实验装置 | 实验步骤 |
| ①将a试管充满二氧化碳,b试管加入紫色石蕊溶液(K处于关闭状态) ②密闭下,用针筒将a试管中部分二氧化碳抽出 |
A. 用针筒将部分二氧化碳抽出,a试管中气体分子间间隙变大
B. 打开K,b试管中液体颜色变红
C. 打开K,导管E液面上升
D. 打开K,发生反应:H2O+CO2=H2CO3
【题目】我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。在制备纯碱的过程中涉及Na2CO3、NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | Na2CO3 | 7 | 12.2 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
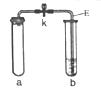
(1)表中三种物质中,溶解性属于可溶的物质是__________。
(2)在50℃时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为___________ ;保持烧杯中各物质质量不变,降温至40℃时,所得溶液溶质的质量分数会_________(填“变小”、“不变”或“变大”)。
(3)请根据表格中数据,在下图中绘制出碳酸钠的溶解度曲线。
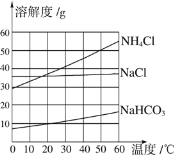 __________
__________
(4)根据溶解度曲线回答下列问题:
①60℃时,向等质量的上述四种固体物质中分别加水配成饱和溶液,所得溶液质量由大到小的顺序是_____________________________。
②侯氏制碱法的关键步骤是:先向饱和食盐水中通入氨气,制成饱和氨盐水,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,其化学方程式为NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3。请问生成的碳酸氢钠和氯化铵,哪种物质首先析出______________,理由是_________________。