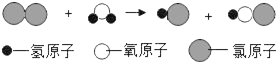
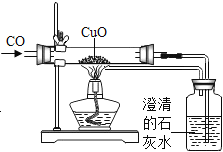
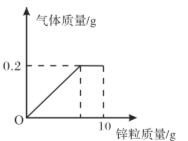
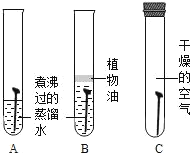
��Ŀ����
����Ŀ����ͼ1���������ֻ������ⶨCO2������̽��ʵ�顣
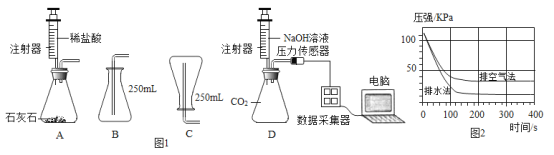
��1������ͼA��ʾ����ʵ��װ�ã�����װ�������Եķ�����_____��
��2����װ��A��ȡCO2���壬���ֱ�����ˮ�����ſ������ռ�����ƿ���屸�ã��������ſ������ռ�ʱ��Ӧѡ�õ�װ��Ϊ_____����B��C����
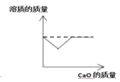
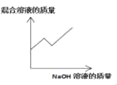
��3������Dͼװ�ã���ע�����е�������Ũ�ȵ�����������Һ�ֱ�ע������ˮ�����ſ������ռ���CO2�������ƿ�ڣ�NaOH��Һ�����������õ���ͼ2��ʾ��ѹǿ��ʱ��仯������ͼ�����û�ѧ����ʽ˵����ƿ��ѹǿ�仯��ԭ��_____��
��4����ʵ��˵��_____�ռ���CO2�ĺ����ϸߣ�������ˮ���������ſ�����������������ͼ˵��������ɣ�_____
��5�������ʵ�飬֤����Ӧ���е�300sʱ����ƿ����Һ�����ʵijɷ�_____��
��6����ʢ��12gʯ��ʯ�����ʲ����뷴Ӧ����Ʒ����ƿ�У�����100gϡ���ᣬ��ַ�Ӧ�����Һ�����ԣ���ƿ�ڹ�������Һ��������Ϊ107.6g���������Ʒ��̼��Ƶ�����_____��
���𰸡���ֹˮ�мн���Ƥ�ܣ����ƻ�����ע�����������ɿ������۲�����Ƿ�ص�ԭ����λ�� B 2NaOH+CO2�TNa2CO3+H2O ��ˮ�� ע������������Һ����ˮ���ռ��������壬��ƿ��ѹǿ�仯�ϴ� ȡ��ƿ����Һ�������Թ��У�����������CaCl2��Һ���а�ɫ�������ɣ�˵��ԭ��Һ�к���̼���ƣ����ϲ���Һ�м����̪��Һ����Һ��죬˵��ԭ��Һ�к����������� 10 g
��������
��1������ͼA��ʾ����ʵ��װ�ã�����Ҫ�γ��ܱտռ䣬������ֹˮ�м�ס��Ƥ�ܣ�Ȼ�����ƻ�����ע�����������ɿ������۲�����Ƿ�ص�ԭ����λ�á�
��2����װ��A��ȡCO2���壬���ſ������ռ������ڶ�����̼���ܶȱȿ������ܶȴ�����Ӧ���������ſ���������Ӧѡ�õ�װ��Ϊ B��
��3������Dͼװ�ã���ע�����е�������Ũ�ȵ�����������Һ�ֱ�ע������ˮ�����ſ������ռ���CO2�������ƿ�ڣ�NaOH��Һ�������������ڶ�����̼���������Ʒ�Ӧ�����µõ���ͼ��ʾ��ѹǿ��ʱ��仯������ͼ����ѹǿ��С����Ӧ�Ļ�ѧ����ʽΪ��CO2+2NaOH��Na2CO3+H2O��
��4����ͼ��ˮ���ռ��Ķ�����̼�����ѹǿ�仯���ԣ�˵����ʵ����ˮ���ռ���CO2�ĺ����ϸߣ����ɣ�ע������������Һ����ˮ���ռ��������壬��ƿ��ѹǿ�仯�ϴ�
��5����Ӧ���е�300sʱ�����ڶ�����̼���������Ʒ�Ӧ����̼���ƣ���ʱ��Ҫȷ���Ƿ���ʣ����������ƣ����Ծ��Ǽ����Ƿ�Ϊ̼���ƺ��������ƵĻ����������ȼ��鲢��ȥ̼���ƣ�Ȼ�������Һ�������ȷ���Ƿ����������ƣ��������Ϊ��ȡ��ƿ����Һ�������Թ��У�����������CaCl2��Һ���а�ɫ�������ɣ�˵��ԭ��Һ�к���̼���ƣ����ϲ���Һ�м����̪��Һ����Һ��죬˵��ԭ��Һ�к����������ơ�
��6������Ʒ��̼��Ƶ�����Ϊx�����������غ㶨�ɣ�����CO2������Ϊ��100g+12g��107.6g��4.4g
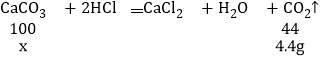
![]() �����x��10 g
�����x��10 g
����Ʒ��̼��Ƶ�����Ϊ10 g��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�