题目内容
【题目】取含杂质的硫酸镁固体样品 15 g(杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液,恰好完全反应,过滤得到一定质量的滤渣和 142 g 溶质质量分数为 10%的滤液。计算:
(1)样品中硫酸镁的质量分数_____;
(2)所加入的氢氧化钠溶液的质量_____。
【答案】80% 135.8g
【解析】
解:硫酸镁和氢氧化钠反应生成氢氧化镁白色沉淀和硫酸钠,恰好完全反应,过滤得到的溶液的溶质为硫酸钠,生成的硫酸钠的质量为142 g×10%= 14.2 g;
设硫酸镁的质量为x,氢氧化镁的质量为y,
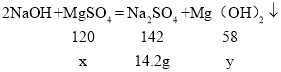
![]()
解得:x=12g,y=5.8g
(1)样品中硫酸镁的质量分数![]() =80%;
=80%;
(2)根据质量守恒定律,所加入的氢氧化钠溶液的质量=142g+5.8g-12g=135.8g。
答:(1)样品中硫酸镁的质量分数80%;
(2)所加入的氢氧化钠溶液的质量135.8g。

练习册系列答案
相关题目