题目内容
【题目】实验室现有一瓶水垢样品,其成分为氢氧化镁和碳酸钙。已知:氢氧化镁受热易分解,反应的化学方程式为:Mg(OH)2![]() MgO + H2O;碳酸钙高温下分解。某兴趣小组为测定其中各成分的质量分数,取12.9g水垢样品加热,加热过程中剩余固体的质量随加热时间的变化如下图所示。关于加热一段时间后剩余固体的判断,下列说法错误的是( )
MgO + H2O;碳酸钙高温下分解。某兴趣小组为测定其中各成分的质量分数,取12.9g水垢样品加热,加热过程中剩余固体的质量随加热时间的变化如下图所示。关于加热一段时间后剩余固体的判断,下列说法错误的是( )
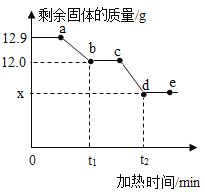
A. 图中a点剩余固体是由一种盐和一种碱组成
B. 若剩余固体中钙元素的质量分数为36.0%,则剩余固体的成分为CaCO3和MgO
C. 图中ab间任一点(不包括a、b两点)的剩余固体成分为CaCO3、MgO和Mg(OH)2
D. 若向c点的剩余固体中加入足量稀盐酸,充分反应生成CO2的质量为(12.0-x)g
【答案】B
【解析】
由题意可知,氢氧化镁受热易分解生成了水蒸气,固体的质量要减少;碳酸钙高温下分解放出了二氧化碳气体,固体的质量要减少,完全反应后,固体的质量不再减少。
A、图中a点剩余固体是氢氧化镁和碳酸钙,是由一种盐和一种碱组成,故A说法正确;
B、由图象可知,生成水的质量为:12.9g-12.0g=0.9g
设氢氧化镁的质量为m
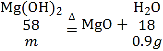
![]() ,解得:m=2.9g
,解得:m=2.9g
则碳酸钙的质量为12.9g-2.9g=10g
设碳酸钙完全分解生成的二氧化碳的质量为n
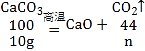
![]() ,解得:n=4.4g
,解得:n=4.4g
x=12.0g-4.4g=7.6g
若碳酸钙完全分解,则剩余固体中钙元素的质量分数是: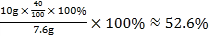 >36.0%,说明了碳酸钙没有完全分解,则剩余固体的成分为CaCO3、MgO、CaO,故B说法错误;
>36.0%,说明了碳酸钙没有完全分解,则剩余固体的成分为CaCO3、MgO、CaO,故B说法错误;
C、图中ab间任一点(不包括a、b两点),说明了氢氧化镁没有完全分解,剩余固体成分为CaCO3、MgO和Mg(OH)2,故C说法正确;
D、由质量守恒定律可知,若向c点的剩余固体中加入足量稀盐酸,充分反应生成CO2的质量为(12.0-x)g,故D说法正确。
故选:B。