题目内容
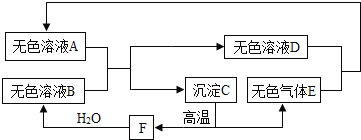
【题目】某溶液可能含有硫酸铜、氯化铜、硝酸钾、硫酸、盐酸中的一种或几种,为了探究其 组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。下列叙述中,正确的是

A.该溶液一定含有盐酸、氯化铜,可能含有硝酸钾
B.加入氢氧化钡溶液至过量,共发生了二个化学反应
C.反应过程生成的沉淀一定有氢氧化铜,可能有硫酸钡
D.到达 b 点时所消耗氢氧化钡溶液中溶质的质量是 17.1 g
【答案】AB
【解析】
由图象可知一开始加入氢氧化钡,没有沉淀,反应一段时间后又产生了沉淀,说明肯定有一种物质能与氢氧化钡产生沉淀,一开始不产生沉淀是因为其中含有酸,酸能把产生的沉淀溶解,所以加入的氢氧化钡先与酸反应,把酸反应完了再与另一种物质反应生成沉淀,酸不能是稀硫酸和硫酸铜,故酸只能是盐酸;也不存在硫酸铜;所以与氢氧化钡产生沉淀只能是氯化铜溶液,所以该混合物组成一定含有盐酸和氯化铜溶液,可能含有硝酸钾。
A、由上述分析可知该溶液一定含有盐酸、氯化铜,可能含有硝酸钾,故选项正确;
B、加入氢氧化钡溶液至过量,共发生了两个化学反应,一是盐酸和氢氧化钡反应生成氯化钡和水,二是氯化铜和氢氧化钡反应生成氢氧化铜蓝色沉淀和氯化钡,故选项正确;
C、由上述分析可知反应过程生成的沉淀一定有氢氧化铜,一定没有硫酸钡,故选项错误;
D、Ba(OH)2+CuCl2=BaCl2+ Cu(OH)2↓,171份质量的氢氧化钡和氯化铜完全反应生成98份质量的氢氧化铜,到达b点时, 17.1 g是氯化铜所消耗氢氧化钡溶液中溶质的质量,由于盐酸的质量不知道,所以盐酸消耗的氢氧化钡无法计算,故不能消耗氢氧化钡溶液中溶质的质量,故选项错误。
故选AB。

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目