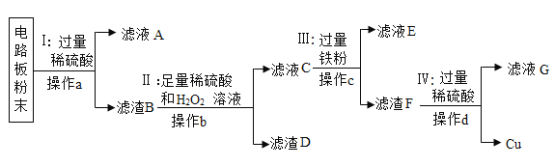
题目内容
【题目】某不纯CaCO3样品中可能含有Na2CO3、MgCO3、 NaHCO3中的一种或几种。现往10g该样品中加入100g稀盐酸恰好完全反应,产生气体质量为Wg,下列说法正确的是()
A.若样品中含有Na2CO3,则产生的气体质量W可能大于4.4g
B.若样品中含有MgCO3和 NaHCO3,则产生的气体质量W可能小于4.4g
C.若样品中含有Na2CO3,则该稀盐酸的溶质质量分数可能大于7.3%
D.若样品中含有MgCO3和Na2CO3,则该稀盐酸的溶质质量分数可能小于7.3%
【答案】D
【解析】
A. 假设10g固体都是碳酸钙,生成二氧化碳的质量为m。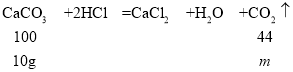
![]() ,解得m=4.4g
,解得m=4.4g
假设10g固体都是碳酸钠,生成二氧化碳的质量为n。
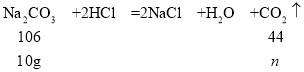
![]() ,解得n≈4.2g
,解得n≈4.2g
故若样品中含有Na2CO3,则产生的气体质量W小于4.4g,此选项错误;
B. 设生成4.4g二氧化碳,消耗碳酸镁的质量为a。
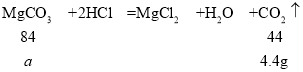
![]() ,解得a=8.4g
,解得a=8.4g
设生成4.4g二氧化碳,消耗碳酸氢钠的质量为x。
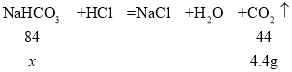
![]() ,解得x=8.4g
,解得x=8.4g
10gCaCO3与足量稀盐酸反应生成4.4g二氧化碳,8.4gMgCO3与足量稀盐酸反应生成4.4g二氧化碳,8.4gNaHCO3与足量稀盐酸反应生成4.4g二氧化碳,若样品中含有MgCO3和NaHCO3,则产生的气体质量W大于4.4g,此选项错误;
C. 假设固体都是碳酸钙,反应的氯化氢的质量为y。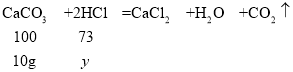
![]() ,解得y=7.3g,此盐酸溶液的溶质质量分数为:
,解得y=7.3g,此盐酸溶液的溶质质量分数为:![]() =7.3%
=7.3%
假设10g碳酸钙固体与足量稀盐酸反应,反应的氯化氢的质量为b。
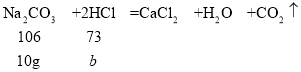
![]() ,解得b≈6.9g,稀盐酸的溶质质量分数为:
,解得b≈6.9g,稀盐酸的溶质质量分数为:![]() =6.9%
=6.9%
故若样品中含有Na2CO3,则该稀盐酸的溶质质量分数小于7.3%,此选项错误;
D. 假设10g碳酸镁固体与足量稀盐酸反应,反应的氯化氢的质量为c。
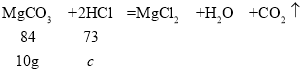
![]() ,解得c≈8.7g,稀盐酸的溶质质量分数为:
,解得c≈8.7g,稀盐酸的溶质质量分数为:![]() =8.7%,
=8.7%,
当固体都是碳酸钠时,稀盐酸的溶质质量分数为6.9%,当固体都是碳酸镁时,稀盐酸的溶质质量分数为8.7%,若样品中含有MgCO3和Na2CO3,则该稀盐酸的溶质质量分数可能小于7.3%,此选项正确。
故选D。

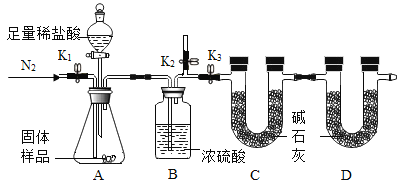
【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:
(阅读资料)
①H2与钙加热可制得CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体。
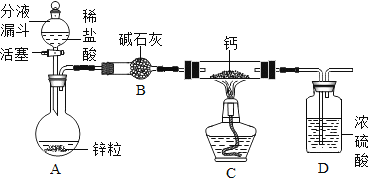
(实验探究)设计的制取装置如图所示:
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置B的作用是_______;根据完整的实验装置进行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后的实验步骤正确的顺序是____(填序号)。
A 加热反应一段时间
B 收集装置最右端导管口处的气体并检验其纯度
C 关闭分液漏斗活塞
D 停止加热,充分冷却
(2)制备CaH2实验结束后,取少量反应后固体小心加入水中,观察到有气泡产生,在溶液中滴入酚酞试液后显______色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一定正确,原因是_______。
(3)取少量上述制得的CaH2样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液,经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将该气体的燃烧产物通入澄清石灰水中,无现象,则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因:_________。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量Na2CO3溶液 | _____ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | _____ | 猜想三成立 |
(定量分析)
CaH2可用于冶金工业,还可以作为轻便的氢气发生剂,现有126克纯净的CaH2,加入足量水中,理论上可获得氢气____升?(常温常压下,氢气的密度为0.09g/L,结果保留一位小数)