题目内容
【题目】下面呈现的是某实验小组在课堂上做的一组探究实验:
(1)在a试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察到的现象是_____。
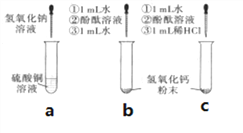
(2)向b、c两支试管中各加入少量相同质量的氢氧化钙粉末,然后各加入1mL水,振荡,呈浑浊状,静置,再各滴入1~2 滴酚酞溶液,观察到两试管溶液均变红。继续向b试管中加入约1mL水振荡;向c试管中加入约1mL稀盐酸,振荡。发现b试管变澄清,溶液仍呈红色,c试管变澄清,溶液变成无色。向b试管中第二次加入约1mL水的作用是________。
(提出问题)试管c中加入约1mL稀盐酸后,溶液中的溶质是什么?
(查阅资料)查阅资料:CaCl2溶液呈中性。
(猜想假设)小丽猜想:I.CaCl2 Ⅱ.CaCl2和HCl Ⅲ.CaCl2和Ca(OH)2
(反思质疑)小明对猜想Ⅲ产生质疑,理由是___________
(进行实验)小组同学通过交流,设计如下实验方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
取少量c试管中的溶液于试管中,_______ | ________ | 猜想Ⅱ成立 |
实验结束,小组同学将a、b、c三支试管中的剩余物质混合,发现废液呈浑浊。
(问题与交流)废液中大量存在的阳离子有_______。写出废液中可能发生反应的一个化学方程式________。
【答案】 有蓝色沉淀生成 对比(合理即可) 因为溶液呈无色,一定不含 Ca(OH)2 滴加几滴石蕊溶液(或加入少量 Mg、Zn 粉或其他合理答案) 溶液变为红色(固体减少,产生气泡或其他合理答案) Na +、Ca 2+(或钠离子、钙离子) :2HCl+Ca(OH)2=CaCl2+2H2O或Cu(OH)2+2HCl=CuCl2+2H2O或HCl + NaOH= NaCl + H 2 O
【解析】
本题考查了实验探究物质的组成成分,酸、碱的化学性质,化学方程式的书写。解答时要根据各种物质的性质,结合各方面条件进行分析、判断得出正确的结论。
(1)在a试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,观察到有蓝色沉淀生成;
(2)向b试管中第二次加入约1mL水的作用是对比,通过对比可知,向b、c两支试管中各加入相同质量的氢氧化钙粉末,然后各加入1mL水,振荡,呈浑浊状,是因为氢氧化钙在水中的溶解度较小;
反思质疑:小明对猜想Ⅲ产生质疑,理由是因为溶液呈无色,一定不含氢氧化钙。
进行实验:若猜想Ⅱ成立,溶液中存在盐酸,盐酸能使石蕊溶液变红色,盐酸能与活泼金属反应产生氢气,可用石蕊溶液(少量 Mg、Zn 粉)检验盐酸的存在,因此:
实验步骤 | 实验现象 | 实验结论 |
取少量c试管中的溶液于试管中,滴加几滴石蕊溶液(或少量 Mg、Zn 粉) | 溶液变红色(或固体减少,产生气泡) | 猜想Ⅱ成立 |
实验结束,小组同学将a、b、c三支试管中的剩余物质混合,发现废液呈浑浊,沉淀是氢氧化铜,废液中不存在盐酸,废液中大量存在的阳离子有反应生成的硫酸钠中的钠离子、生成的氯化钙中的钙离子;废液中可能发生的反应有:稀盐酸和氢氧化钙反应生成氯化钙和水,稀盐酸和氢氧化铜反应生成氯化铜和水,稀盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O,Cu(OH)2+2HCl=CuCl2+2H2O,HCl + NaOH= NaCl + H2 O。