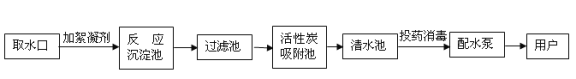
题目内容
【题目】资料:白磷着火点为40 ℃,红磷的着火点为240 ℃,五氧化二磷能污染空气,五氧化二磷易溶于水。
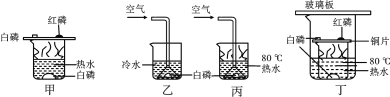
(1)在探究可燃物燃烧条件的课堂上,老师利用图甲所示进行实验。实验时观察到的现象是:__________;
(2)小明同学设计了乙、丙2个对比实验,完成了探究过程,得到以下实验事实:
①不通空气时,冷水中的白磷不燃烧;②通入空气时,冷水中的白磷不燃烧;③不通入空气时,热水中的白磷不能燃烧;④通入空气时,热水中的白磷燃烧。
该实验中,能证明可燃物的温度必须达到着火点才能燃烧的事实是_________________ (填序号,下同);能证明可燃物通常需要接触空气才能燃烧的实验事实是_________________。
(3)结合老师与小明设计的实验,小强设计了实验装置丁,小明与小强的实验都比老师的实验有个明显的优点,这个优点是_________________。
(4)乙醇是一种清洁燃料,但在氧气不足时燃烧会生成一氧化碳,现有207 g乙醇与一定量的氧气点燃后发生如下反应:3C2H5OH+8O2![]() xCO2+2CO+9H2O
xCO2+2CO+9H2O
①根据质量守恒定律可知:x=_________________;
②计算该反应生成一氧化碳的质量_________________。
【答案】铜片上的红磷和水中的白磷不燃烧,铜片上的白磷燃烧,产生大量的白烟②④③④防止污染空气484g
【解析】
(1)在探究可燃物燃烧条件的课堂上,老师利用图甲所示进行实验。实验时观察到的现象是:铜片上的红磷和水中的白磷不燃烧,铜片上的白磷燃烧,产生大量的白烟;故答案为:铜片上的红磷和水中的白磷不燃烧,铜片上的白磷燃烧,产生大量的白烟;
(2)该实验中,能证明可燃物的温度必须达到着火点才能燃烧的事实是:②通入空气时,冷水中的白磷不燃烧;④通入空气时,热水中的白磷燃烧;能证明可燃物通常需要接触空气才能燃烧的实验事实是:③不通入空气时,热水中的白磷不能燃烧;④通入空气时,热水中的白磷燃烧;
(3)结合老师与小明设计的实验,小强设计了实验装置丁,小明与小强的实验都比老师的实验有个明显的优点,这个优点是:防止污染空气;
(4)解:根据碳原子守恒可得x=4,设生成的一氧化碳的质量为y,
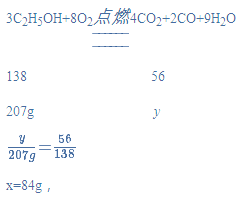
答:①根据质量守恒定律可知:x=4;②该反应生成的一氧化碳的质量为84g。

【题目】在制取CO2的实验中,小科发现质量相同而粗细不同的大理石与盐酸反应,CO2的产生速度细的比粗的快得多.
(1)经思考后,小科设计了如下实验.请你完成下表:(每次实验用大理石质量1g,盐酸20mL)
实验序号 | 实验温度 | 大理石颗粒 | 盐酸质量分数(%) | 实验目的 |
① | 20 | 粗 | 5 | 实验①②:探究大理石和盐酸的反应速率与大理石颗粒粗细的关系; 实验①③:探究大理石和盐酸的反应速率与________的关系 |
② | ______ | 细 | 5 | |
③ | 20 | 粗 | 10 |
(2)为了比较反应速度,设计如图所示装置,其中量筒的作用是________.

(3)实验①中CO2体积随时间的变化关系如图所示,请在图上画出实验②中CO2体积随时间变化关系的预期结果________.
【题目】下面呈现的是某实验小组在课堂上做的一组探究实验:
(1)在a试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察到的现象是_____。
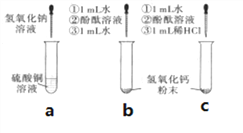
(2)向b、c两支试管中各加入少量相同质量的氢氧化钙粉末,然后各加入1mL水,振荡,呈浑浊状,静置,再各滴入1~2 滴酚酞溶液,观察到两试管溶液均变红。继续向b试管中加入约1mL水振荡;向c试管中加入约1mL稀盐酸,振荡。发现b试管变澄清,溶液仍呈红色,c试管变澄清,溶液变成无色。向b试管中第二次加入约1mL水的作用是________。
(提出问题)试管c中加入约1mL稀盐酸后,溶液中的溶质是什么?
(查阅资料)查阅资料:CaCl2溶液呈中性。
(猜想假设)小丽猜想:I.CaCl2 Ⅱ.CaCl2和HCl Ⅲ.CaCl2和Ca(OH)2
(反思质疑)小明对猜想Ⅲ产生质疑,理由是___________
(进行实验)小组同学通过交流,设计如下实验方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
取少量c试管中的溶液于试管中,_______ | ________ | 猜想Ⅱ成立 |
实验结束,小组同学将a、b、c三支试管中的剩余物质混合,发现废液呈浑浊。
(问题与交流)废液中大量存在的阳离子有_______。写出废液中可能发生反应的一个化学方程式________。