题目内容
【题目】质量均为 x 的锌粉和铁粉分别与 100g 9.8%的稀硫酸充分反应,产生的 H2的质量与反应时间的关系如图所示,下列说法正确的是( )
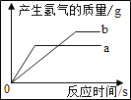
A. b 曲线表示锌的反应图象
B. 当 x<5.6 g 时,两种金属都反应完,酸过量
C. 当 5.6 g<x<6.5 g 时,和铁反应的稀硫酸过量
D. x 可能大于 6.5 g
【答案】B
【解析】
A、a曲线生成的氢气少,所以a是锌粉与稀硫酸反应的曲线,故A错误;
B、Zn+H2SO4=ZnSO4+H2↑

Fe+H2SO4=FeSO4+H2↑

所以当x<5.6g时,两种金属都反应完,酸过量,故B正确;C、当5.6g<x<6.5g时,和铁反应的稀硫酸完全反应,故C错误;D、x大于6.5g时,金属过量,酸完全反应,生成的氢气质量相等,故D错误。故选B。

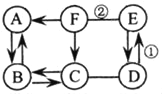
【题目】下面呈现的是某实验小组在课堂上做的一组探究实验:
(1)在a试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察到的现象是_____。
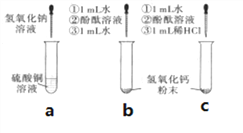
(2)向b、c两支试管中各加入少量相同质量的氢氧化钙粉末,然后各加入1mL水,振荡,呈浑浊状,静置,再各滴入1~2 滴酚酞溶液,观察到两试管溶液均变红。继续向b试管中加入约1mL水振荡;向c试管中加入约1mL稀盐酸,振荡。发现b试管变澄清,溶液仍呈红色,c试管变澄清,溶液变成无色。向b试管中第二次加入约1mL水的作用是________。
(提出问题)试管c中加入约1mL稀盐酸后,溶液中的溶质是什么?
(查阅资料)查阅资料:CaCl2溶液呈中性。
(猜想假设)小丽猜想:I.CaCl2 Ⅱ.CaCl2和HCl Ⅲ.CaCl2和Ca(OH)2
(反思质疑)小明对猜想Ⅲ产生质疑,理由是___________
(进行实验)小组同学通过交流,设计如下实验方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
取少量c试管中的溶液于试管中,_______ | ________ | 猜想Ⅱ成立 |
实验结束,小组同学将a、b、c三支试管中的剩余物质混合,发现废液呈浑浊。
(问题与交流)废液中大量存在的阳离子有_______。写出废液中可能发生反应的一个化学方程式________。
【题目】学习了溶液的概念后,老师的提问及同学的回答如下图所示:

![]() 以上三位同学中能够正确描述溶液特征的是________同学.老师接着问:“你们还想知道什么?”王华回答:“影响物质在水中溶解能力的因素有哪些?”
以上三位同学中能够正确描述溶液特征的是________同学.老师接着问:“你们还想知道什么?”王华回答:“影响物质在水中溶解能力的因素有哪些?”
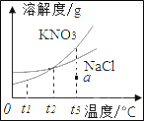
![]() 针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在右边的坐标图中绘制
针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在右边的坐标图中绘制![]() 、
、![]() 两物质的溶解度曲线(图中注明
两物质的溶解度曲线(图中注明![]() 、
、![]() ).________
).________
温度 |
|
|
|
| |
溶解度 |
|
|
|
|
|
|
|
|
|
| |
![]() 该实验主要探究了温度对固体物质溶解度的影响,在一定温度范围内,
该实验主要探究了温度对固体物质溶解度的影响,在一定温度范围内,![]() 物质的饱和溶液溶质质量分数大于
物质的饱和溶液溶质质量分数大于![]() 物质的饱和溶液溶质质量分数,该温度范围是________.
物质的饱和溶液溶质质量分数,该温度范围是________.
![]() 将在
将在![]() ゜
゜![]() 时等量的
时等量的![]() 、
、![]() 饱和溶液同时降温到
饱和溶液同时降温到![]() ゜
゜![]() ,则析出晶体的质量
,则析出晶体的质量![]() ________
________![]() (填“大于”、“等于”或“小于”).
(填“大于”、“等于”或“小于”).
![]() 在
在![]() ゜
゜![]() 时,向
时,向![]() 水中加入
水中加入![]() 物质充分溶解后,形成的
物质充分溶解后,形成的![]() 物质溶液质量是________
物质溶液质量是________![]() .
.
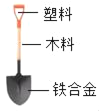
【题目】金属与人类的生产、生活密切相关,牢固掌握金属的知识十分必要。
(1)下列用途是利用了金属的导电性的是________(填字母代号)。
A.铜作导线 B.金作戒指
C.铝合金作门窗 D.铁锅作炊具
(2)将一小块金属钠放入滴有无色酚酞溶液的水中,钠剧烈反应,可观察到其熔成小球,在水面上游动,溶液变成红色。
①请根据上述现象总结金属钠的物理性质(写出两点即可)_________________。
②已知该反应还产生了一种可燃性气体,请写出此反应的化学方程式_______________。
(3)将锌粉加到含有 Cu(NO3)2 和 AgNO3 的混合溶液中,充分反应后过滤。
①若滤液中只含有一种溶质,请分析滤渣的成分_______________。
②若滤渣中含有两种金属,请分析滤液的成分_______________。
(4)合金的种类很多,用途十分广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等,化学兴趣小组的同学欲测定某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量 10 g 粉末状黄铜样品放入烧杯中,量取 45 mL 稀盐酸分三次加入其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试计算:①m 的数值为________。
②此黄铜样品中铜的质量分数是多少__________________