题目内容
【题目】碱式碳酸铜[Cu2(OH)2CO3]用作农药防治小麦黑穗病。实验室用加热法测定某农药中碱式碳酸铜的质量分数(假设杂质受热不参与反应)。充分加热100g样品,得到固体84.5g。已知反应的化学方程式为:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑,Cu2(OH)2CO3的相对分子质量为222。试计算:
2CuO+H2O+CO2↑,Cu2(OH)2CO3的相对分子质量为222。试计算:
(1)Cu2(OH)2CO3中质量分数最大的元素是_______。
(2)若用100g 98%的浓硫酸充分吸收反应所产生的水,得到硫酸溶液的溶质质量分数是多少_______? (计算结果精确到0.1%)
(3)样品中碱式碳酸铜的质量分数是多少______________?
【答案】 氧元素(或O) 93.8% 55.5%
【解析】(1)![]() ,Cu2(OH)2CO3中质量分数最大的元素是氧元素(或O);
,Cu2(OH)2CO3中质量分数最大的元素是氧元素(或O);
解法一:(2)由质量守恒定律得生成水和二氧化碳的质量为:100g-84.5g==15.5g
由反应的化学方程式可知,生成水和二氧化碳的质量比为:18:44==9:22
生成水的质量为:15.5g×![]() == 4.5g
== 4.5g
所得硫酸溶液的溶质质量分数为:
![]() ×100%≈93.8%
×100%≈93.8%
(3)设样品中碱式碳酸铜的质量为x。
Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
222 18
x 4.5g
222/18=x/4.5g x == 55.5g
样品中碱式碳酸铜的质量分数为:![]() ×100%==55.5%
×100%==55.5%
答:(2)所得硫酸溶液的溶质质量分数为93.8%,
(3)样品中碱式碳酸铜的质量分数为55.5%
解法二:解:设样品中碱式碳酸铜的质量为x,生成水的质量为y。
反应后固体的质量减少为:100g-84.5g==15.5g
Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑ 固体质量减少
2CuO+H2O+CO2↑ 固体质量减少
222 18 62
x y 15.5g
222/62=x/15.5g x == 55.5g
18/62=y/15.5g y == 4.5g
(2)所得硫酸溶液的溶质质量分数为:![]() ×100%≈93.8%
×100%≈93.8%
(3)样品中碱式碳酸铜的质量分数为:![]() ×100%==55.5%
×100%==55.5%
答:(2)所得硫酸溶液的溶质质量分数为93.8%,
(3)样品中碱式碳酸铜的质量分数为55.5%

 应用题天天练四川大学出版社系列答案
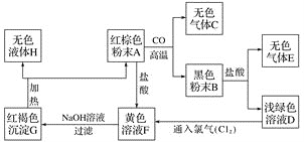
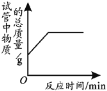
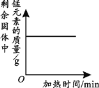
应用题天天练四川大学出版社系列答案【题目】根据下列表格中的信息回答问题。
A.过氧化氢溶液和二氧化锰混合 | B.加热高锰酸钾 | C.硫燃烧 |
|
|
|
(1)A、B实验中数据变化关系与对应图像相符的是____(填字母序号)。
(2)A中反应的文字表达式是____。
(3)C中可观察到硫在氧气中燃烧,发出____火焰,生成______气味的无色气体,此反应的文字表达式___________。