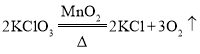题目内容
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的应用与金属导热性有关的是_____。
A 铁锤 B 铁锅 C 菜刀
(2)“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的_____。
II.铁的冶炼
工业炼铁的主要反应原理是在高温下CO夺取铁矿石里的氧,将铁还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:_____;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能_____。
Ⅲ.铁的活动性探究
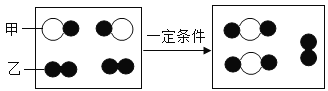
现用一定量的AgNO3和Cu (NO3)2混合溶液,进行了如下图所示的实验,并对溶液A和固体B的成分进行了分析和研究。
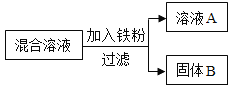
(提出问题)溶液A中的溶质成分可能有哪些?
(作出猜想)
①只有Fe(NO3)2
②有Fe(NO3)2、AgNO3
③有Fe(NO3)2、Cu(NO3)2
④有Fe(NO3)2、Cu(NO3)2、AgNO3
(交流讨论)不合理的猜想是_____(填序号)。
(实验探究)根据下表中的实验步骤及现象,完成表中的实验结论。
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加稀盐酸 | 有气泡产生 | 溶液A中的溶质成分符合猜想_____(填序号),固体B中有_____种金属。 |
Ⅳ.生铁中铁含量的测定
某课外兴趣小组测定生铁(含杂质的铁,杂质既不溶于水也不溶于酸)中铁的质量分数,他们取6份样品,分别与稀硫酸反应。测得数据如下,请根据有关信息回答问题。
实验次数 | 1 | 2 | 3 | 4 | 5 | 6 |
取样品质量(g) | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
取稀硫酸质量(g) | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 | 300.0 |
产生气体质量(g) | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 | 1.05 |
(1)第5次实验结束后,所得溶液中溶质的化学式为_____。
(2)所用稀硫酸中溶质的质量分数为_____。
(3)若配制上述浓度的稀硫酸100克,则需质量分数为98%的浓硫酸_____克。
(4)计算该样品中铁的质量分数是_____。(写出计算过程)
【答案】B 水蒸气和氧气 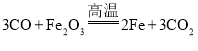 提供热量 ② ① 3 FeSO4 19.6% 20g 98%
提供热量 ② ① 3 FeSO4 19.6% 20g 98%
【解析】
I.(1)分析所给三种金属制品可以知道,铁锅是利用了金属的导热性;
(2)铁吸收水与氧气后会变成铁锈,所以“双吸剂”它能够吸收空气中的水分和氧气;
II. (1)赤铁矿的主要成分是氧化铁,氧化铁和一氧化碳反应能生成铁和二氧化碳,反应的化学方程式为: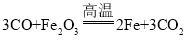 ;
;
(2)炼铁时要用到焦炭,它有两个作用,炼铁时需要高温,焦炭与氧气反应生成二氧化碳,同时放出大量热,可供给炼铁使用;炼铁时还需一氧化碳作还原剂,二氧化碳与过量焦炭反应可以生成一氧化碳;
Ⅲ.[交流讨论] 不合理的猜想是:②,其理由是:铁优先和银离子反应,然后才和铜离子反应,当硝酸银有剩余时,硝酸铜不参加反应,所以应该有硝酸铜;
[实验探究]取少量固体B,滴加稀盐酸,有气泡产生,说明固体含有铁,所以铜和银全部转化为单质,所以溶液溶液A中的溶质成分符合猜想①,只有硝酸亚铁,固体B中的金属成分有铁、铜、银3种;
Ⅳ.(1)根据前四次分析可知,每50.0g稀硫酸对应0.2g氢气,第5次实验结束后,由于样品中还有铁,所以所得到溶液中溶质的化学式为: FeSO4;
(2)根据分析可知第1次实验硫酸完全反应,设硫酸的质量分数为x,

![]() ,
,
x= 19.6%;
(3)需要质量分数为98%的浓硫酸的质量=![]() =20g;
=20g;
(4)生成氢气的总质量为1.05g,设该样品中单质铁的质量分数为y,
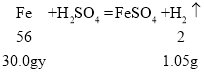
![]() ,
,
y=98%。