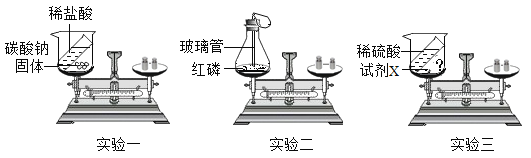
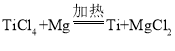题目内容
【题目】A、B、C、D都是初中化学常见的物质,它们关系如下图所示(反应条件略去)。
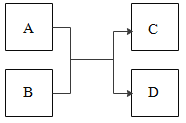
(1)若A为一氧化碳,C为金属,则D化学式为_____________________;
(2)若A为常见金属,C为气体单质,则B化学式为_____________________;
(3)若A为蓝色溶液,C为浅绿色溶液,则B化学式为_____________________;
(4)若D为白色沉淀,则反应方程式为_____________________;
【答案】CO2 Fe Fe ![]()
【解析】
(1)若A为一氧化碳,C为金属,则该反应为一氧化碳还原金属氧化物的过程,得到金属单质和二氧化碳,即D为CO2;
(2)若A为常见金属,C为气体单质,可能为活泼金属单质与酸的反应,金属可为Fe,酸可为稀盐酸或稀硫酸等,则B化学式为Fe(合理即可);
(3)若A为蓝色溶液,则为含铜离子的溶液;C为浅绿色溶液,则为含有亚铁离子的溶液,反应为铁与铜的盐溶液发生置换反应,因此B为Fe;
(4)若D为白色沉淀,则可为氯化银,因此方程式可为:![]() (合理即可)。
(合理即可)。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的应用与金属导热性有关的是_____。
A 铁锤 B 铁锅 C 菜刀
(2)“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的_____。
II.铁的冶炼
工业炼铁的主要反应原理是在高温下CO夺取铁矿石里的氧,将铁还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:_____;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能_____。
Ⅲ.铁的活动性探究
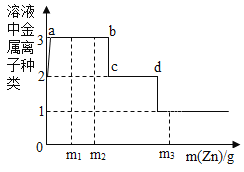
现用一定量的AgNO3和Cu (NO3)2混合溶液,进行了如下图所示的实验,并对溶液A和固体B的成分进行了分析和研究。
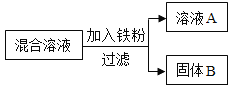
(提出问题)溶液A中的溶质成分可能有哪些?
(作出猜想)
①只有Fe(NO3)2
②有Fe(NO3)2、AgNO3
③有Fe(NO3)2、Cu(NO3)2
④有Fe(NO3)2、Cu(NO3)2、AgNO3
(交流讨论)不合理的猜想是_____(填序号)。
(实验探究)根据下表中的实验步骤及现象,完成表中的实验结论。
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加稀盐酸 | 有气泡产生 | 溶液A中的溶质成分符合猜想_____(填序号),固体B中有_____种金属。 |
Ⅳ.生铁中铁含量的测定
某课外兴趣小组测定生铁(含杂质的铁,杂质既不溶于水也不溶于酸)中铁的质量分数,他们取6份样品,分别与稀硫酸反应。测得数据如下,请根据有关信息回答问题。
实验次数 | 1 | 2 | 3 | 4 | 5 | 6 |
取样品质量(g) | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
取稀硫酸质量(g) | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 | 300.0 |
产生气体质量(g) | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 | 1.05 |
(1)第5次实验结束后,所得溶液中溶质的化学式为_____。
(2)所用稀硫酸中溶质的质量分数为_____。
(3)若配制上述浓度的稀硫酸100克,则需质量分数为98%的浓硫酸_____克。
(4)计算该样品中铁的质量分数是_____。(写出计算过程)