��Ŀ����
����Ŀ��Ԫ�����ڱ���ѧϰ���о���ѧ����Ҫ���ߡ������ͼʾ�ش���Ӧ����
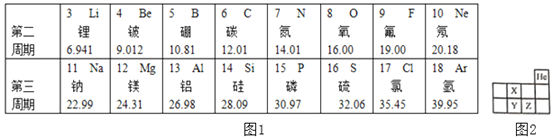
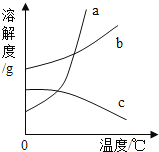
��1��ԭ������Ϊ1��7��8������Ԫ���γɵĵ��ʵĻ�ѧʽ��_____��
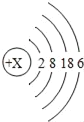
��2��ͼ2ΪԪ�����ڱ���һ���֣�X��Y��Z�������ֲ�ͬԪ�أ�����_____�жϴ���
A ԭ������Z��Y B �����������X��Y C Y��Z����ͬһ����
��3����ͼ2�з�����X����Ԫ�أ���Z��ԭ��������������_____��
��4��������ͬԭ�����͵������ķ��ӻ����ӽеȵ����壬�ȵ�����������ƵĽṹ�����ʣ����и��������в����ڵȵ��������_____������ĸ��ţ���
A CO��N2 B SO2��CO2 C PO43����SO42��
��5��д��һ���ڶ�����Ԫ��ԭ�ӵĺ˵�����仯���ɣ�_____��
��6����Ԫ������Ԫ�صı���������_____��
���𰸡�NH4NO3 B 7 B �����ң�ԭ�ӵĺ˵�������ε��� ��������ͬ����˵������ͬ��
��������
��1����ԭ������Ϊ1����Ԫ�أ���7����Ԫ�أ���8����Ԫ�أ�������Ԫ����ɵĵ�����NH4NO3�����NH4NO3��
��2��
A��ͬһ�����У���������ԭ���������ε��������ԭ��������Z��Y����ѡ��˵����ȷ��
B��ͬһ���У��������º�����Ӳ��������ε��������Ե�����Ҳ�����������X<Y,��˵������ȷ��
C��Y��Z����ͬһ�����У�����ͬһ���ڣ���ѡ��˵����ȷ��
��ѡ��B��
��3��X����Ԫ�أ���YԪ������Ԫ�أ���ԭ���������6�����ӣ���Z�����ȣ���ԭ��������������7�����7��
��4�������������������ͼ��֪��C��N��S��P��Oԭ�������ֱ���6��7��16��15��8��ԭ������������������ԭ���ڲ���������=�˵����=������������ɵ��������ݣ�
A��ÿ��һ����̼���Ӻ�ÿ���������ӵ�ԭ�Ӹ�����Ϊ2�����Ӹ����ֱ���6+8=14��7+7=14�����ڵȵ����塣
B��ÿ������������Ӻ�ÿ��������̼���ӵ�ԭ������Ϊ3���������ֱ���16+8��2=32��6+8��2=22�������ڵȵ����塣
C��ÿ����������Ӻ�ÿ����������ӵ�ԭ�Ӹ�����Ϊ5�����Ӹ����ֱ���15+8��4+3=50��16+8��4+2=50�����ڵȵ����塣
���B��
��5���ڶ�����Ԫ��ԭ�ӵĺ˵�����仯�����Ǵ����ң�ԭ�ӵĺ˵�������ε�������������ң�ԭ�ӵĺ˵�������ε�����
��6��Ԫ���Ǿ�����ͬ�˵����������������һ��ԭ�ӵ��ܳƣ�������Ԫ������Ԫ�صı�����������������ͬ��˵������ͬ�������������ͬ����˵������ͬ����