题目内容
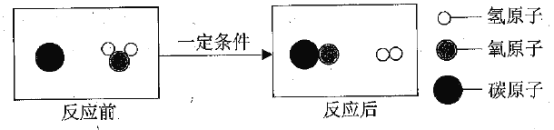
【题目】工业上用甲和乙两种物质在一定条件下反应生成丙和X,反应的微观示意图如图。参加反应的甲和乙及生成丙的质量比为甲:乙:丙=23:17:1.下列判断错误的是
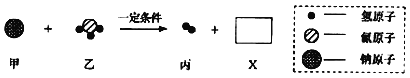
A. 丙属于单质
B. 参加反应的乙与生成丙的分子个数之比为1:1
C. 物质X中含三种元素
D. 甲这种物质是由原子直接构成的
【答案】B
【解析】根据提供的信息可知,甲是钠,乙是氨气,钠和氨气反应生成氢气和X,X中至少含有钠元素和氮元素,属于化合物。根据“该反应中甲、乙、丙的质量比为23:17:1”,当生成2份质量的氢气时,消耗钠、氨气的质量分别是46份、34份,则X中钠元素质量为46份,氮元素质量为34份×![]() ×100%=28份,氢元素的质量为:46份+34份﹣2份﹣46份﹣28份=4份,则X中钠元素、氮元素、氢元素的质量比为:46份:28份:4份=23:14:2,故物质X中含三种元素;则其化学方程式为2Na+2NH3=H2+2NaNH2,故该反应方程式中乙与丙的化学计量数之比为2:1。A、丙是氢气,属于单质,正确;B、由化学方程式可知:参加反应的乙与生成丙的分子个数之比为2:1,错误;C、由上述分析可知:物质X中含三种元素,正确;D、甲是钠,是由原子直接构成的,正确。故选B。
×100%=28份,氢元素的质量为:46份+34份﹣2份﹣46份﹣28份=4份,则X中钠元素、氮元素、氢元素的质量比为:46份:28份:4份=23:14:2,故物质X中含三种元素;则其化学方程式为2Na+2NH3=H2+2NaNH2,故该反应方程式中乙与丙的化学计量数之比为2:1。A、丙是氢气,属于单质,正确;B、由化学方程式可知:参加反应的乙与生成丙的分子个数之比为2:1,错误;C、由上述分析可知:物质X中含三种元素,正确;D、甲是钠,是由原子直接构成的,正确。故选B。

 口算题天天练系列答案
口算题天天练系列答案【题目】Ⅰ.请结合下图回答问题。
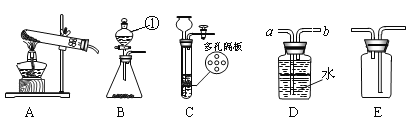
(1)写出图中有标号仪器的名称: ①__________________。
(2)用高锰酸钾制取一瓶干燥的氧气,可选用装置组合为___________(选填序号);实验室制取二氧化碳和氧气可选用发生装置C或B,C装置的优点是__________________,用此装置制取O2的化学方程式是____________________;
(3)实验室常用甲酸(HCOOH)溶液滴加到浓硫酸中制CO气体,可选用的制取装置是______(选填序号)。该反应中浓硫酸既是催化剂又是脱水剂,试写出该反应的化学方程式________________。
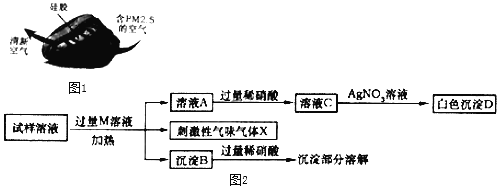
Ⅱ.某同学将氢氧化钠溶液滴入到一定量的稀氯化铜溶液中,出现蓝绿色不溶于水的固体。该同学对生成蓝绿色而不是蓝色固体的现象产生疑惑。
(查阅资料)
(1).CuCl2溶液与NaOH溶液反应可生成蓝色固体(Cu(OH)2),在氢氧化钠较少的情况下会生成蓝绿色碱式氯化铜(Cux(OH)yClz),其不溶于水,能与酸反应。
(2).Cu(OH) 2在60℃开始分解生成两种氧化物,100℃分解完全。碱式氯化铜在300℃开始分解生成氧化铜、水和氯化氢,在400℃分解完全。
(猜想)蓝绿色固体可能是:①Cu(OH)2;②Cux(OH)yClz晶体;③_______。猜想①的理由是:________(用化学方程式表示)。
(验证)该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体。则猜想 ________不正确。继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图_____(选填“甲”或“乙”)装置(装置中药品足量)。

(实验数据) ①最终得到剩余固体24.00g;
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体14.35g;
③浓硫酸装置中数据如表。
加热前 | 100℃ | 400℃ |
250.00g | 251.80g | 253.60g |
(得出结论)猜想③成立,且碱式氯化铜中X∶Y:Z = _________。
(拓展延伸)
为使实验中生成蓝色固体,少出现蓝绿色固体,应作_______________改进(选填序号)。
a.实验中将氯化铜溶液滴加到氢氧化钠溶液中
b.实验中应提供足量、较浓的氢氧化钠溶液
c.实验应该在80℃的水浴中进行
【题目】如图为实验室常见的气体制备、收集和性质的实验装置,据图回答。
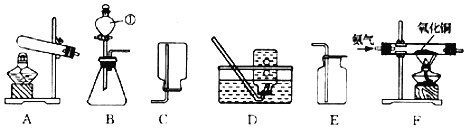
(1)指出B装置中标号仪器名称:①_____。
(2)实验室用大理石与稀盐酸反应制取CO2应选择的发生装置是_____(填装置序号,下同),收集装置是_____,反应的化学方程式是_____。
(3)实验室用加热氯化铵和氢氧化钙固体混合物制取氨气,应选择的发生装置是_____。为探究氨气的性质,小红利用图中F装置进行氨气与氧化铜反应的实验,实验中观察到黑色氧化铜粉末变成红色。
(提出问题)得到的红色粉末是什么?
查阅资料:Cu2O是红色,易与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O
(猜想假设)红色粉末是①Cu②Cu2O③_____
(设计实验)小明设计如下实验验证红色粉末中是否含有Cu2O:
实验步骤 | 实验现象 | 实验结论 |
取红色粉未于试管中,加人足量稀硫酸 | _____ | 红色粉末中含有Cu2O |
(实验反思)小明设计的实验无法证明红色粉末中是否含有Cu,原因是_____。