题目内容
【题目】实验室用如图1所示装置的部分或全部组合后完成如下实验,请回答下列问题:
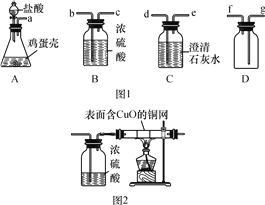
(1)鸡蛋壳的主要成分是碳酸钙,A装置中发生反应的化学方程式为_______________________,A与C相连后C中的现象为________________________。
(2)若将A装置中的药品换成双氧水和二氧化锰,产生的O2经浓硫酸干燥后用D装置收集,导管口的连接顺序应是a→b→c→________。
(3)若将A装置中的药品换成硫酸铜溶液和铁粉,发现生成红色固体物质的同时有较多的气泡放出。老师提示,该反应生成的气体只有一种。
【猜想】放出的气体可能是SO2、O2、H2中的一种,提出猜想的依据是________________。
【资料】SO2易溶于水,化学性质与二氧化碳相似,能使澄清石灰水变浑浊,生成CaSO3。
【方案】依据上述猜想,实验小组同学分别设计了如下方案。
①甲同学认为是O2,则检验方法是________________________________________________。
②乙同学认为是SO2,则只需将装置A、C相连,看澄清石灰水是否变浑浊即可。写出SO2与Ca(OH)2反应的化学方程式:________________________________。
③丙同学在乙同学实验装置的基础上增加了如图2所示的装置,观察到试管中产生的现象是________________________。
【结论】经过实验,得出结论:放出的气体为H2。
(4)在氢气还原氧化铜的实验中,向50 g氧化铜粉末中通氢气,加热一段时间后,测得反应后生成水的质量为9 g。求已反应掉的氧化铜的质量_________________(写出计算过程)。
【答案】 CaCO3+2HCl===CaCl2+H2O+CO2↑ 澄清的石灰水变浑浊 g 质量守恒定律 带火星的木条检验,看木条是否复燃 SO2+Ca(OH)2===CaSO3↓+H2O 铜网表面的黑色物质变红 40 g
【解析】根据所学知识和题中信息知,(1)鸡蛋壳的主要成分是碳酸钙,A装置中发生反应的化学方程式为∶CaCO3+2HCl==CaCl2+H2O+CO2↑,A与C相连后C中的现象为澄清的石灰水变浑浊,二氧化碳可以使澄清的石灰水变浑浊。(2)若将A装置中的药品换成双氧水和二氧化锰,产生的O2经浓硫酸干燥后用D装置收集,导管口的连接顺序应是a→b→c→g。(3)若将A装置中的药品换成硫酸铜溶液和铁粉,发现生成红色固体物质的同时有较多的气泡放出。【猜想】放出的气体可能是SO2、O2、H2中的一种,提出猜想的依据是质量守恒定律。【资料】SO2易溶于水,化学性质与二氧化碳相似,能使澄清石灰水变浑浊,生成CaSO3。
【方案】①甲同学认为是O2,则检验方法是∶带火星的木条检验,看木条是否复燃,若能就是氧气。②乙同学认为是SO2,则只需将装置A、C相连,看澄清石灰水是否变浑浊即可。SO2与Ca(OH)2反应的化学方程式:SO2+Ca(OH)2=CaSO3↓+H2O。③丙同学在乙同学实验装置的基础上增加了如图2所示的装置,观察到试管中产生的现象是铜网表面的黑色物质变红。【结论】经过实验,得出结论:放出的气体为H2。(4)解∶设已反应掉的氧化铜的质量是x
CuO+H2 ![]() Cu+H2O
Cu+H2O
80 18
X 9g
![]() =
=![]() ,x=40 g.
,x=40 g.
答∶已反应掉的氧化铜的质量是40 g。
点睛∶这是一道实验探究题,正确掌握实验探究方法和本质是对学生的基本要求,是完成此实验的保证。

 智能训练练测考系列答案
智能训练练测考系列答案