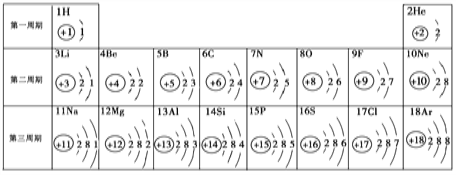
题目内容
【题目】结合如图实验装置图回答问题

(1)用A图制取二氧化碳气体,反应的化学方程式为:________,若锥形瓶内的反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭,则是由于A 装置存在缺陷,其缺陷为________;
(2)图 B、C、D 是探究二氧化碳化学性质的实验,证明二氧化碳与氢氧化钠溶液发生反应的现象是________;
(3)图 E 和 F 是探究哪种离子能促进 H2O2 分解的实验,现象是:E 中产生大量气泡,F 中没有明显现象,则促进 H2O2 分解的离子符号是________。
II工业烧碱中常含有杂质碳酸钠.某兴趣小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.
(实验思路)利用 Na2CO3与稀 H2SO4反应产生 CO2,通过测定产生的 CO2质量,确定样品中碳酸钠的质量,计算样品纯度.
(实验方案)小明根据以上思路,设计了如图甲的实验方案(固定装置省略).
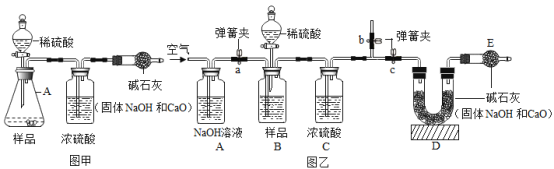
(1)A 中发生的化学反应方程式有________.
(2)浓硫酸的作用为________.
(3)能说明样品中的碳酸钠完全反应的现象是________.
(交流讨论)经讨论,小组同学一致认为图甲中小明设计的实验方案有缺陷,则因方案设计缺陷而导致误差的因素有________(填序号).
①加入的稀硫酸量不足 ②装置内空气中的 CO2 没有排出
③反应产生的 CO2 未被完全吸收 ④干燥管与空气直接相通
(实验改进)为减少误差,使测定生成 CO2 的质量更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略).图乙 B 装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时 a、b、c 三个弹簧夹的控制方法是________.
(数据分析)该实验测定工业烧碱的纯度,需要收集的数据有________,若撤去图乙中的A 装置,实验步骤同上,则测得工业烧碱的纯度将__________ (填“偏高”、“偏低”或“无影响”).
【答案】CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 长颈漏斗未伸到液面以下 D 中试管内液面上升,且上升高度比 B 高 Fe3+ Na2CO3+ H2SO4= Na2SO4+H2O+CO2↑、H2SO4+2NaOH=Na2SO4+2H2O 干燥气体 继续滴加稀硫酸时,不再有气泡产生 ②③④ 先关闭 c,再打开 a、b 样品的质量和 D 装置增加的质量 偏低
【解析】
(1)根据反应物是石灰石和盐酸,生成物是氯化钙、水和二氧化碳,反应方程式是:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑;若锥形瓶内的反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭,则是由于A 装置存在缺陷,其缺陷为长颈漏斗未伸到液面以下,生成的二氧化碳会从长颈漏斗散逸到空气中;
(2)二氧化碳能够溶于水,如果试管中液面D比B上升的更高,说明二氧化碳与氢氧化钠溶液发生了反应。图 B、C、D 是探究二氧化碳化学性质的实验,证明二氧化碳与氢氧化钠溶液发生反应的现象是D 中试管内液面上升,且上升高度比B高;
(3)E、F中都含有氯离子,E中产生大量气泡,F中没有明显现象,说明能够促进H2O2分解的离子是Fe3+;
II
实验方案:
(1)根据图可知A中发生的化学反应为碳酸钠与稀硫酸反应、稀硫酸与氢氧化钠溶液反应,其化学方程式分别为:Na2CO3+ H2SO4= Na2SO4+H2O+CO2↑、H2SO4+2NaOH=Na2SO4+2H2O;
(2)浓硫酸的作用为吸水干燥二氧化碳气体.
(3)能说明样品中的碳酸钠完全反应的现象是继续滴加稀硫酸时,不再有气泡产生;
交流讨论:
经讨论,小组同学一致认为图甲中小明设计的实验方案有缺陷,则因方案设计缺陷而导致误差的因素有:装置内空气中的CO2没有排出;反应后,锥形瓶仍有二氧化碳,产生的CO2未被完全吸收;干燥管与空气直接相通,会吸收空气中的水和二氧化碳,导致测量结果不准确。故选②③④;
实验改进:
图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是先关闭c,再打开a、b;
数据
该实验测定工业烧碱的纯度,需要收集的数据有样品的质量和D装置增加的质量(产生的二氧化碳质量,可根据二氧化碳质量求出样品中碳酸钠的质量),若撤去图乙中的A装置,实验步骤同上,空气中的二氧化碳也会被D装置中碱石灰吸收,侧得样品中碳酸钠质量分数偏高,而工业烧碱的纯度将偏低。

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
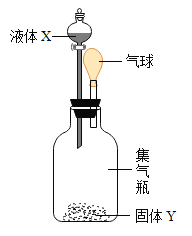
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
A.①②③④⑤B.①②④C.①③④D.①④⑤
【题目】(2011年浙江宁波,19题、)将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X。测得反应前后物质的质量如下表:
物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 6.6 | 2.7 | m |
下列判断正确的是 ( )
A.表中m的值为13.5 B.该反应属于分解反应
C.物质X能在氧气中燃烧 D.物质X中一定含有氢元素
【题目】归纳、分类是学习化学的重要方法。
(1)请根据物质的构成角度从下图4种物质中选出部分物质归为一类,回答下列问题:
|
|
|
|
①铅笔中的石墨 | ②体温计中的水银 | ③实验室制取的蒸馏水 | ④用于超导体等方面的C60 |
选出的一组物质的化学式有_____________,分类的依据是__________。
(2)实验室制取的蒸馏水烧瓶中加入碎瓷片的作用___________。
(3)查阅资料可知:过氧化钠(Na2O2)能与水发生如下反应2Na2O2+2H2O=4NaOH+O2↑,而过氧化钙(CaO2)与过氧化钠类似也能与水反应,写出该反应的化学方程式___________ 。