题目内容
【题目】真真实验小组欲亲自探究适合在实验室制取二氧化碳的药品。她们准备利用碳酸钠粉未、块状大理石、稀盐酸、浓盐酸、稀硫酸五种药品进行实验探究
(提出问题)上述药品间的相互反应都适合在实验室制取二氧化碳气体吗?
(方案设计)(1)经过讨论大家都致认为浓盐酸不适合用于实验室制取二氧化碳你认为原因是___。
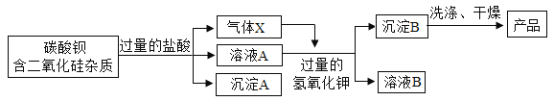
(2)真真小组同学经过反复设计研究后确定迸行如下图所示的四个实验
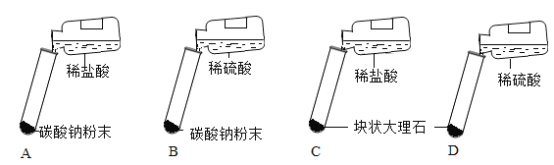
(结论分析)实验报告单如下表
实验编号 | 实验现象 | 实验结论 |
A | 剧烈反应,迅速产生大量气泡 | 反应速率过快,不便于气体收集 |
B | 剧烈反应,迅速产生大量气泡 | _________ |
C | ______ | 便于收集,适合在实验室制取CO2 |
D | 一开始产生气泡,之后便迅速减慢直到反应几乎停止 | 因为无法持续的产生气体,不适合用在实验室制取二氧化碳 |
(3)①结合上面的实验探究报告,可用于实验室制取二氧化碳气体的化学反应方程式为___;
②在确定实验室制取气体反应原理时,要考虑诸多因素,请你再写出一种需要考虑的因素:___;
(继续探究)在实验室里,小组同学利用12.3%的稀盐酸与块状大理石来制取二氧化碳。
(问题引入)(4)实验结束后发现裝置内废液中还有块状固体存在,但已观察不到气泡产生,反应后的废液中还有盐酸吗?甲同学用pH试纸测得该废液的pH=2,证明___;
(5)反应后废液中剩余的块状固体中还有碳酸钙吗?乙同学带着疑问取岀废液中块状的固体,洗净后放入试管中, 再加入约2mL的___, 立即产生大量的气泡, 证明___。
(猜想验证)(6)既然反应后废液中还有盐酸和碳酸钙,那为何观察不到实验现象呢?
①同学认为是废液中盐酸浓度太低,所以观察不到现象。甲同学将少许___置于试管中,加入约2mLpH=1的稀盐酸,立即观察到有气泡冒出
②乙同学认为是实验所用大理石块较大,与盐酸接触不充分,所以观察不到明显的现象,于是乙同学向老师要了一些纯净的碳酸钙粉未放入试管中,加入约2ml___,立即观察到有气泡冒出
(实验结论)
(7)依据(4)(5)确定发生反应后装置废液中的盐酸与碳酸钙共存,但不能观察到现象。结合实验(6)①②闸述其原因___;
(拓展延伸)(8)实验室用块状大理石与稀盐酸反应 pH至气泡逸出不明显后,测得残留液 pH=2,若取适量残留液体的上层清液于试管中,逐滴滴入碳酸钠溶液至过量。请在下图中绘出变化趋势___。

【答案】浓盐酸具有强挥发性,会发出HCl使收集到的CO2不纯 反应速率过快,不便于收集气体 固体逐渐溶解,有气泡产生 CaCO3+2HCl=CaCl2+H2O+CO2↑ 制取过程中是否会产生有害物质、实验条件是否节能 溶液中有盐酸剩余 12.3%的稀盐酸 有碳酸钙剩余 废液中残留的块状固体 废液中的上清液 稀盐酸的浓度过低,大理石与酸的接触面积过小,所以观察不到现象 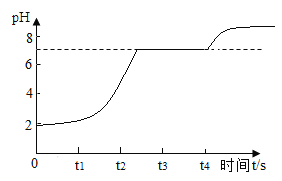
【解析】
碳酸钙和稀盐酸生成氯化钙、水和二氧化碳,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。
[方案设计](1) 浓盐酸具有强挥发性,故经过讨论大家都致认为浓盐酸不适合用于实验室制取二氧化碳,原因是浓盐酸具有强挥发性,会发出HCl使收集到的CO2不纯。
[结论分析]碳酸钠和稀盐酸、稀硫酸反应速率较快,不便于收集生成的二氧化碳气体,稀硫酸和碳酸钙反应生成硫酸钙微溶物覆盖在大理石表面,阻止反应发生,实验室常用碳酸钙和稀盐酸反应制取氧气。
实验编号 | 实验现象 | 实验结论 |
A | 剧烈反应,迅速产生大量气泡 | 反应速率过快,不便于气体收集 |
B | 剧烈反应,迅速产生大量气泡 | 反应速率过快,不便于收集气体 |
C | 固体逐渐溶解,有气泡产生 | 便于收集,适合在实验室制取CO2 |
D | 一开始产生气泡,之后便迅速减慢直到反应几乎停止 | 因为无法持续的产生气体,不适合用在实验室制取二氧化碳 |
(3)①实验室制取二氧化碳气体的反应是碳酸钙和稀盐酸生成氯化钙、水和二氧化碳,反应的化学方程式为![]() 。
。
②在确定实验室制取气体反应原理时,要考虑诸多因素,需要考虑的因素是制取过程中是否会产生有害物质、实验条件是否节能。
[问题引入](4) pH小于7的溶液,显酸性,甲同学用pH试纸测得该废液的pH=2,证明溶液中有盐酸剩余。
(5)稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,取岀废液中块状的固体,洗净后放入试管中, 再加入约2mL的12.3%的稀盐酸, 立即产生大量的气泡, 证明有碳酸钙剩余。
[猜想验证](6)①废液中盐酸浓度太低,所以观察不到现象,则用浓度较高的稀盐酸做实验,故甲同学将少许废液中残留的块状固体置于试管中,加入约2mLpH=1的稀盐酸,立即观察到有气泡冒出。
②乙同学认为是实验所用大理石块较大,与盐酸接触不充分,所以观察不到明显的现象,于是乙同学向老师要了一些纯净的碳酸钙粉未放入试管中,加入约2ml废液中的上清液,立即观察到有气泡冒出。
[实验结论](7)稀盐酸和大理石反应,稀盐酸的浓度要达到一定量,大理石的面积要较小,故原因是稀盐酸的浓度过低,大理石与酸的接触面积过小,所以观察不到现象。
[拓展延伸](8)实验室用块状大理石与稀盐酸反应 pH至气泡逸出不明显后,测得残留液 pH=2,溶液显酸性,取适量残留液体的上层清液于试管中,上层清液含有盐酸,逐滴滴入碳酸钠溶液至过量,碳酸钠先和盐酸反应生成氯化钠、水和二氧化碳,随着反应的进行,pH增大,盐酸完全反应后,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,反应完全pH=7,碳酸钠过量,pH增大,故图像为 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】甲、乙两种固体在不同温度时的溶解度如下表所示。请回答下列问题:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度(g) | 甲 | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 |
乙 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | |
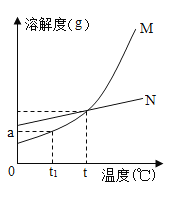
(1)依据上表数据,绘制出甲、乙两物质的溶解度曲线(如图所示),图中能表示甲物质溶解度曲线的是______;(填“M”或“N”)
(2)若t1=10℃,则a=________;
(3)40℃时,将30g甲物质溶于50g水中,充分搅拌,所得溶液中溶质的质量分数是_______(精确到0.1%);
(4)从甲、乙混合溶液中提纯乙的方法是________;
(5)t℃时甲、乙两物质的溶解度相等,此时t的取值范围是______。
A. 10~20 B. 20~30 C. 30~40 D. 40~50