题目内容
【题目】为测定硫酸铜与硫酸钠的混合溶液中溶质硫酸铜的质量分数,取该溶液100g,再将 120g一定质量分数的氢氧化钠溶液分6次加入到该溶液中,充分反应后,测得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加入氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
生成沉淀物的质量/g | 1.96 | 3.92 | 5.88 | 7.84 | 9.8 | 9.8 |
(1)滴加氢氧化钠溶液的过程中的现象是: 。
(2)该混合溶液中溶质硫酸铜的质量分数是多少?
【答案】(1)有蓝色沉淀生成;(2)16%
【解析】
根据表格提供的数据,前5次实验中每加入20g氢氧化钠溶液,都是生成1.96g沉淀,而第6次加入20g氢氧化钠溶液,沉淀没有增加,说明第5次加入20g氢氧化钠溶液,氢氧化钠和硫酸铜恰好完全反应。因此根据前5次反应生成的沉淀质量可以计算得出该混合溶液中溶质硫酸铜的质量,然后根据溶液中溶质质量分数的计算公式,求出混合溶液中溶质硫酸铜的质量分数。
(1)因为混合溶液中硫酸钠不与氢氧化钠反应,只有硫酸铜与氢氧化钠反应生成蓝色的氢氧化铜沉淀,所以滴加氢氧化钠溶液的过程中,现象是:有蓝色沉淀生成。
(2)解:设混合溶液中溶质硫酸铜的质量为x。
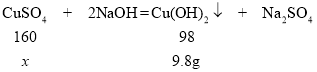
![]()
解得x=16g
混合溶液中溶质硫酸铜的质量分数为:![]()
答:该混合溶液中溶质硫酸铜的质量分数是16%。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】实验室现有硫酸镁和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸镁的质量分数,先称取该混合物样品20g,完全溶于100g水中。然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(1)上表中X的数值为______;原固体混合物样品中硫酸镁的质量分数是 ;
(2)求恰好完全反应时,溶液中溶质的质量分数。(结果精确到0.1%)
(3)请在下图中画出在20 g 样品中加氢氧化钠溶液的质量与产生沉淀质量变化关系的示意图。
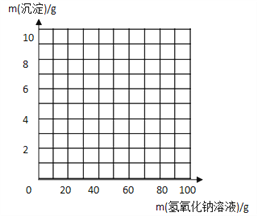
(4)若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由。