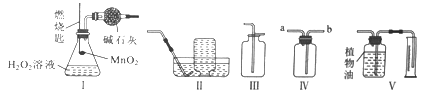
题目内容
【题目】在密闭容器中,分别用温度和压强传感器测定铝片和稀盐酸反应过程中的图像如下,下列结论不正确的是( )
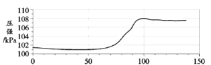
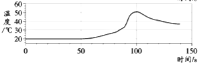
A. 反应过程中有热量放出
B. 0~50s,变化不明显,是因为铝表面有一层致密氧化铝薄膜 发生稀盐酸与Al的反应
C. 60s~100s气体压强增大,是因为温度升高
D. 100s后温度降低是因为反应停止
【答案】C
【解析】
A、由于温度升高,说明了反应过程中有热量放出,故A正确,不符合题意;
B、0~50 s时,变化不明显,是因为铝表面有一层致密氧化铝薄膜,氧化铝与稀盐酸反应生成了氯化铝和水,没有气体生成,而且反应放热比较少,故B正确,不符合题意;
C、60~100 s气体压强升高,是生成了气体的原因和温度升高两个因素导致,故C错误,符合题意;
D、100 s后温度降低是因为反应停止的原因,故D正确,不符合题意。
故选:C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案【题目】测定石灰石中碳酸钙的质量分数,取该石灰石样品5g,把 60g稀盐酸分四次加入,实验过程所得数据如下表(杂质不溶于水,也不与稀盐酸反应)。根据实验数据计算:
实验次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 15 | 15 | 15 | 15 |
剩余固体的质量/g | 3.50 | 2.00 | 0.75 | 0.75 |
(1)石灰石样品中碳酸钙的质量分数为______________。
(2)求稀盐酸中溶质质量分数?______。
(3)求反应后所得溶液中生成物溶质质量分数?_________。
【题目】鱼浮灵(主要成分是过碳酸钠(2Na2CO3·3H2O2))是水产养殖中常见的增氧剂,溶于水后生成Na2CO3和H2O2,能迅速增加水体溶氧量,某课外小组用右图装置探究促进H2O2分解的因素。
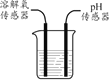
(查阅资料)H2O2常温下分解很慢。
NaCl溶于水解离出Na+和Cl-。
Na2CO3溶于水解离出Na+和CO32-,CO32-与水作用使溶液呈碱性。
(猜想与假设)①.Na+促进H2O2分解。②.溶液的碱性促进H2O2分解。
(进行实验)
探究一:分别进行下列3个实验(80mL蒸馏水中加入6.7g“鱼浮灵”,所得溶液中H2O2的浓度约为4%)。
实验 | 实验内容 | 实验结果 | |
pH | 溶解氧(mg/L) | ||
1 | ① 80 mL蒸馏水 | 6.96 | 5.68 |
② 加“鱼浮灵”6.7g | 9.89 | 7.97 | |
2 | ① 80 mL 4%的H2O2溶液 | 6.01 | 6.44 |
② 加少量NaCl | 6.00 | 6.46 | |
③ 再加少量Na2CO3 | 8.14 | 9.11 | |
3 | 80 mL 4%的H2O2溶液中加少量NaOH溶液 | 9.26 | 10.97 |
(解释与结论)
(1)根据实验1的实验结果,加入“鱼浮灵”后,液体的变化是______。
(2)通过实验______,证明猜想1不成立。
(
探究二:向5个烧杯中分别加入80mL4%的H2O2溶液,再分别滴加NaOH溶液,测得不同pH下的溶解氧情况如下表所示。
烧杯 | 1 | 2 | 3 | 4 | 5 |
pH | 8.00 | 8.59 | 9.29 | 10.43 | 11.47 |
溶解氧(mg/L) | 6.88 | 9.30 | 13.82 | 17.57 | 13.15 |
(4)探究二得出的结论是______。
(反思与评价)
(5)下列物质能加快H2O2分解的是_______。
A MnO2 B NaCl C NaOH D Na2CO3
(6)探究一中,实验2-①与实验1-①对比,溶解氧增大的原因是______。