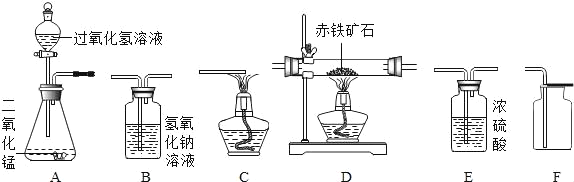
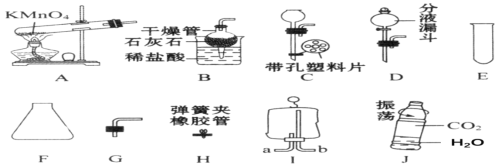
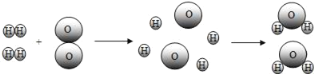
题目内容
【题目】欲提纯某白铜(主要成分为Cu和Ni)样品中的Cu、Ni两种金属,其主要流程如图(部分反应产物在图中已略去),已知:Ni与Fe化学性质相似,常见化合价为+2价。
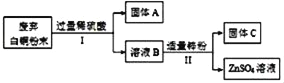
(1)固体A的化学式是_____。
(2)Ⅰ中反应的化学方程式是_____。
(3)Ⅱ中分离出固体C的操作名称是_____。
(4)由上述流程得出Cu、Ni、Zn的金属活动性由强到弱的顺序是_____。
【答案】Cu Ni+H2SO4═NiSO4+H2↑ 过滤 Zn、Ni、Cu 。
【解析】
由题意可知,Ni与Fe化学性质相似,所以向废弃白铜(Cu、Ni)粉末中加入过量的稀硫酸,镍能与稀硫酸反应,铜不与硫酸反应,说明A是铜,得到的溶液B中含有硫酸镍和剩余的硫酸;加入适量的锌粉,则锌能与硫酸反应生成硫酸锌和氢气,能与硫酸镍反应生成了镍和硫酸锌,所以得到的固体C中含有置换出来的镍。
(1)由上述分析可知,固体A是铜,化学式是Cu;
(2)I中镍能与稀硫酸反应生成了氢气和硫酸镍,反应的化学方程式是Ni+H2SO4═NiSO4+H2↑;
(3)II中分离出固体C的操作名称是过滤;
(4)由上述流程可知,铜不与硫酸反应,镍能与稀硫酸反应,锌能将镍从气溶液中置换出来,可得出Cu、Ni、Zn的金属活动性由强到弱的顺序是Zn、Ni、Cu。

【题目】实验小组以鸡蛋壳(主要成分CaCO3,在水中能溶解出微量的Ca2+,其他成分对实验影响忽略不计)为牙齿的替代物,模拟含氟牙膏保护牙齿的化学原理。
(查阅资料)①含氟牙膏保护牙齿的原因:含氟牙膏中的NaF能与牙齿表面溶解的微量Ca2+反应,生成更难溶于酸的物质。
②常温下,酚酞溶液遇pH<8.2的碱性溶液不变色。
(进行实验)实验小组用2种不同的方法进行实验。
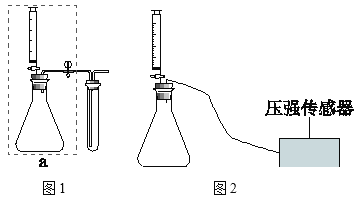
实验一:如图连接仪器,进行实验。
实验组 | 对照组 | |
锥形瓶中的物质 | 0.5g用含氟牙膏处理过的鸡蛋壳 | 0.5g未用含氟牙膏处理过的鸡蛋壳 |
注射器中的物质 | 20mL3.5%的盐酸 | m |
试管中的物质 | 滴有酚酞的氢氧化钠稀溶液 | 滴有酚酞的氢氧化钠稀溶液 |
试管中溶液褪色时间(s) | t1 | t2 |
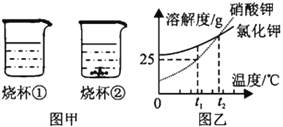
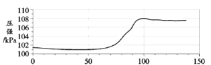
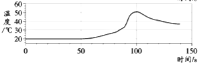
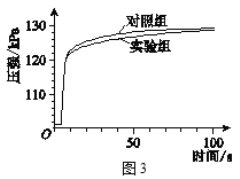
实验二:如图连接仪器,锥形瓶和注射器中的物质均与实验一相同。进行实验,测量压强随时间的变化
如图所示。
(解释与结论)
(1)装入药品前,检查装置a的气密性:用止水夹夹住右侧橡皮管,______,说明装置气密性良好。
(2)实验一中:
①鸡蛋壳中主要成分与盐酸反应的化学方程式为______。
②m处应填写的是______。
(3)实验二能证明含氟牙膏对鸡蛋壳有保护作用,其理由是______。由此推断出实验一中,t1______t2(填“>”、“<”或“=”)。
(反思与评价)
(4)根据本实验模拟的含氟牙膏保护牙齿的化学原理,推测下列摩擦剂一定不能用于制作含氟牙膏的是______(填序号)。
A CaCO3 B SiO2(二氧化硅) C Al(OH)3