题目内容
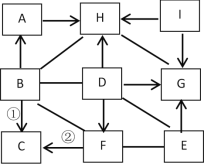
【题目】实验室配制100 g 溶质质量分数为5%的氯化钠溶液。实验操作如下:
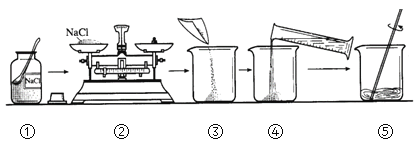
(1)操作④中量筒的量程是_____(填“10 mL”、“50 mL”或“100 mL”)。
(2)若操作③中有部分固体洒落桌面,所得溶液的溶质质量分数会_____(填“偏大”、“不变”或“偏小”)。
(3)配制好的溶液要装在试剂瓶中,并贴好标签。请在如图的标签中填上相应的内容。
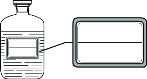 _____
_____
【答案】100ml 偏小 氯化钠溶液5%
【解析】
(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g=95g;
(2)若操作③中有部分固体洒落桌面,溶质的质量减少,所得溶液的溶质质量分数会减少;
(3)标签中填上相应的内容是溶液的名称、溶质的质量分数,图2的标签中填上相应的内容是:氯化钠溶液,5%。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】实践活动中,化学小组的同学用下图所示装置进行如下实验。(说明:暖宝宝的原料中有铁粉、碳粉和少量氯化钠)

实验步骤 | 主要操作 | 实验现象 | 结论与解释 |
I | 按上图所示装置连接仪器。关闭止水夹,打开分液漏斗活塞,向分液漏斗中加入水 | ________________。 | 装置气密性良好。 |
II | 用集气瓶收集一瓶氧气,并向其中加入暖宝宝的原料。塞进橡胶塞,在分液漏斗和烧杯中分别加入水和稀盐酸,放置一段时间 | 集气瓶内无明显现象 | |
III | 打开止水夹和分液漏斗活塞,向集气瓶中加入少量水,关闭止水夹。 | 观察到部分液体变为棕红色。 | 暖宝宝原料中的部分铁被氧化 |
IV | 打开止水夹 | 稀盐酸流入集气瓶中,并有气泡产生 | 稀盐酸倒吸入集气瓶中的原因是__________。 产生气泡的原因是(用化学方程式表示)________。 |
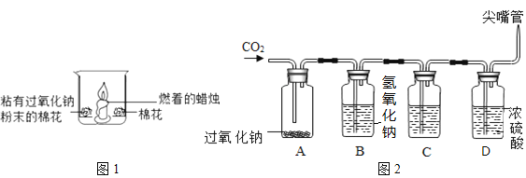
【题目】氧气、二氧化碳是我们身边常见的物质。某兴趣小组对这两种气体研究如下:
Ⅰ.氧气、二氧化碳的制备:
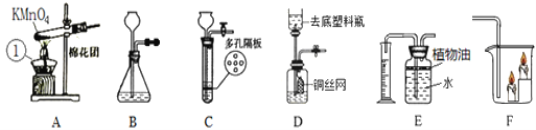
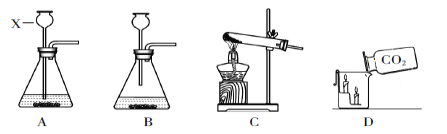
(1)写出A图中有标号仪器①的名称:__________。
(2)写出用KMnO4制取O2的化学方程式___________________,该装置中棉花团的作用是__________,图中装置一处明显的错误是__________。
(3)在化学实验室中用石灰石和稀盐酸来制取二氧化碳可选用图B所示的发生装置,该反应的化学方程式是__________。
(4)制二氧化碳也可选用如图C所示的装置,与B装置相比,C装置的优点是_________,用图D装置也可以制取二氧化碳,将石灰石放在铜丝网中,该实验说明了铜____(填“能”或“不能”)和稀盐酸发生反应。
Ⅱ.二氧化碳的性质及氧气的收集研究:
(1)二氧化碳的性质研究
①如图E所示的装置可以测定一段时间收集的二氧化碳的体积,植物油的作用是____。
②如图F所示的装置说明了二氧化碳具有__________的性质,该性质在实际生活中的应用是__________。
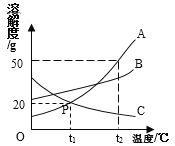
③已知:CO2和SO2既有相似性,又有差异性。
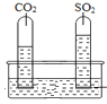
实验一:将收集满两种气体的试管同时倒立于盛水的水槽中,片刻后实验现象如图所示,说明相同条件下SO2比CO2__________(填“易”或“难”)溶于水。
实验二:已知镁条可以在CO2中剧列燃烧: 2Mg+CO2![]() 2MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧,__________。
2MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧,__________。
(2)氧气的收集
(实验1)用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
(实验2)用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
(实验3)用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1 | 实验2 | 实验3 | |||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | ||||||
数据①由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是__________。
②不考虑操作因素,实验3获得的氧气体积分数不能达到100%的主要原因是_________。