题目内容
【题目】氧气、二氧化碳是我们身边常见的物质。某兴趣小组对这两种气体研究如下:
Ⅰ.氧气、二氧化碳的制备:
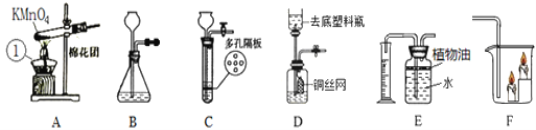
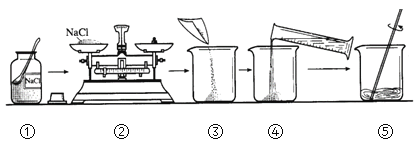
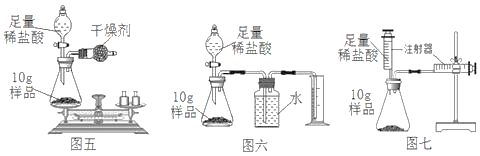
(1)写出A图中有标号仪器①的名称:__________。
(2)写出用KMnO4制取O2的化学方程式___________________,该装置中棉花团的作用是__________,图中装置一处明显的错误是__________。
(3)在化学实验室中用石灰石和稀盐酸来制取二氧化碳可选用图B所示的发生装置,该反应的化学方程式是__________。
(4)制二氧化碳也可选用如图C所示的装置,与B装置相比,C装置的优点是_________,用图D装置也可以制取二氧化碳,将石灰石放在铜丝网中,该实验说明了铜____(填“能”或“不能”)和稀盐酸发生反应。
Ⅱ.二氧化碳的性质及氧气的收集研究:
(1)二氧化碳的性质研究
①如图E所示的装置可以测定一段时间收集的二氧化碳的体积,植物油的作用是____。
②如图F所示的装置说明了二氧化碳具有__________的性质,该性质在实际生活中的应用是__________。
③已知:CO2和SO2既有相似性,又有差异性。
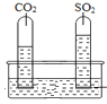
实验一:将收集满两种气体的试管同时倒立于盛水的水槽中,片刻后实验现象如图所示,说明相同条件下SO2比CO2__________(填“易”或“难”)溶于水。
实验二:已知镁条可以在CO2中剧列燃烧: 2Mg+CO2![]() 2MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧,__________。
2MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧,__________。
(2)氧气的收集
(实验1)用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
(实验2)用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
(实验3)用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1 | 实验2 | 实验3 | |||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | ||||||
数据①由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是__________。
②不考虑操作因素,实验3获得的氧气体积分数不能达到100%的主要原因是_________。
【答案】酒精灯 2KMnO4 ![]() K2MnO4 + MnO2 + O2 ↑ 防止高锰酸钾进入导管 试管口向上倾斜 CaCO3 + 2HCl ==== CaCl2 + H2O +CO2 ↑ 控制反应的发生和停止 不能 防止二氧化碳溶于水,并与水反应 密度比空气大,不能燃烧也不支持燃烧 灭火等 易 生成白色固体和黄色固体,放热 验满后继续收集一段时间(合理即可) 气体中含有较多水蒸气(合理即可)
K2MnO4 + MnO2 + O2 ↑ 防止高锰酸钾进入导管 试管口向上倾斜 CaCO3 + 2HCl ==== CaCl2 + H2O +CO2 ↑ 控制反应的发生和停止 不能 防止二氧化碳溶于水,并与水反应 密度比空气大,不能燃烧也不支持燃烧 灭火等 易 生成白色固体和黄色固体,放热 验满后继续收集一段时间(合理即可) 气体中含有较多水蒸气(合理即可)
【解析】
Ⅰ.(1)①是酒精灯。
(2)KMnO4在加热条件下发生反应生成锰酸钾、二氧化锰、氧气。该装置中棉花团的作用是防止高锰酸钾进入导管,给固体加热时,试管口要略向下倾斜。
(3)实验室中用石灰石和稀盐酸来制取二氧化碳,石灰石主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水、二氧化碳。
(4)关闭C装置的止水夹,气体不能排出,试管内压强变大,稀盐酸被压进长颈漏斗中,与石灰石分离,反应停止,打开止水夹,稀盐酸从长颈漏斗中流出,液面上升,稀盐酸与石灰石接触,反应发生,所以C装置的优点是能随时控制反应的发生和停止。D装置中的铜丝网与稀盐酸接触,实验说明了铜不能和稀盐酸发生反应。
Ⅱ.(1)①二氧化碳易溶于水,并能与水反应,装置E中植物油的作用是防止二氧化碳溶于水、与水反应。②装置F中的下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳先占据下方空间,即二氧化碳的密度比空气的密度大,还说明二氧化碳不能燃烧也不支持燃烧,在实际生活中利用该性质灭火。③将收集满两种气体的试管同时倒立于盛水的水槽中,片刻后盛二氧化硫的试管中进入的水多,说明相同条件下SO2比CO易溶于水。镁条可以在CO2中剧列燃烧:2Mg+CO2![]() 2MgO+C,可推测镁条在SO2中燃烧生成氧化镁和硫,氧化镁是白色固体,硫是黄色固体,可推测实验现象是剧列燃烧、生成白色固体和黄色固体,放热。
2MgO+C,可推测镁条在SO2中燃烧生成氧化镁和硫,氧化镁是白色固体,硫是黄色固体,可推测实验现象是剧列燃烧、生成白色固体和黄色固体,放热。
(2)①由实验数据可知,当放置在集气瓶口带火星木条复燃后,继续收集40秒,瓶中氧气的含量高,所以用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是验满后继续收集一段时间。②用排水法获得的氧气体积分数不能达到100%的主要原因是气体中含有较多水蒸气。

 期末宝典单元检测分类复习卷系列答案
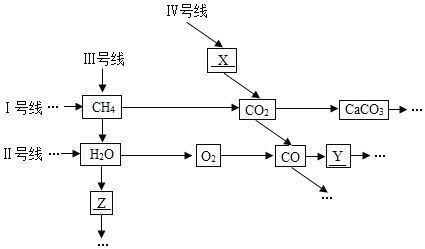
期末宝典单元检测分类复习卷系列答案【题目】在一密闭容器中,物质X不完全燃烧时可以产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,正确的是
物质 | X | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. X中碳元素的质量分数为52.2% B. X中只含有C、H两种元素
C. 表中a的值为3.4 D. 无法确定X中是否含有氧元素
【题目】水是生命之源,人类的生产、生活都离不开水。
(1)自然界中的水含有许多可溶性和不溶性杂质。长期饮用硬水可能会引起体内结石,生活中常用____________的方法来降低水的硬度。
(2)水是常用的溶剂,配制下列溶液时,以水做溶剂的是_______(填序号)。
A.生理盐水 B.医用碘酒 C.高锰酸钾溶液 D.医用酒精
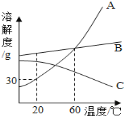
(3)下表是NaCl、KNO3在不同温度时的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①根据表中的数据,在坐标纸上绘制出氯化钠和硝酸钾两种物质的溶解度曲线。(请用铅笔在答题卡的坐标纸上绘图)________
②根据绘制的氯化钠和硝酸钾的溶解度曲线判断,温度大约在_____℃时,两种物质的溶解度大小相等。
③现有氯化钠和硝酸钾各40g ,30℃时,分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是______(填溶质名称), 将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的方法是_____。
④在60℃时,硝酸钾的溶解度是110g。这句话的含义是______。
(4)以太阳能为热源,经由铁氧化合物循环分解水的过程如右图所示:
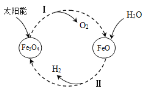
① 写出在一定条件下发生的反应Ⅱ的化学方程式______。
② 在上述循环过程中,最终得到的产品是________。