题目内容
【题目】二氧化碳能与过氧化钠(Na2O2,淡黄色固体)在常温下反应产生氧气,并生成碳酸钠,且伴有能量的释放。
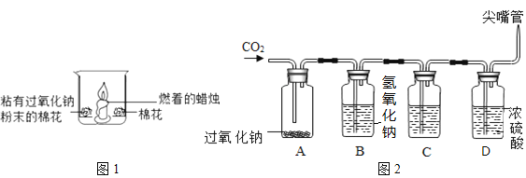
(1)如图1所示,在空气中放置时,两团棉花均不燃烧;若将足量二氧化碳倒入烧杯时,可以观察到的现象有:①______;②粘有过氧化钠的棉花燃烧;③未粘有过氧化钠的棉花不燃烧。通过上述实验的对比分析,写出产生现象②的原因______。
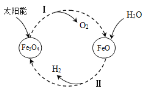
(2)为验证二氧化碳能与过氧化钠在常温下反应产生氧气,设计了图2实验(氢氧化钠溶液能与二氧化碳反应;浓硫酸有吸水性,且既不与二氧化碳反应,也不与氧气反应)。
①B瓶的作用是吸收未反应完的二氧化碳,C瓶的作用是检验二氧化碳是否被B瓶吸收完,则C瓶中盛放的溶液是______(写名称)。
②为验证过氧化钠和二氧化碳反应生成氧气,采用的验证方法是______。
③写出过氧化钠和二氧化碳反应的化学方程式_____。
【答案】)蜡烛的火焰熄灭 过氧化钠与二氧化碳反应生成氧气并放出热量,使棉花与氧气接触,同时温度上升到棉花的着火点 澄清石灰水 用一根带火星的木条放在尖嘴管口,若发现木条复燃,则说明反应生成了氧气 2Na2O2+2CO2=2Na2CO3+O2
【解析】
(1)二氧化碳不支持燃烧,所以将足量二氧化碳倒入烧杯时,蜡烛的火焰熄灭;产生现象②的原因是:过氧化钠与二氧化碳反应生成氧气并放出热量,使棉花与氧气接触,同时温度上升到棉花的着火点;
(2)①C瓶的作用是检验二氧化碳是否被B瓶吸收完,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,C瓶中盛放的溶液是澄清石灰水;
②氧气具有助燃性,能使带火星的木条复燃,所以为验证过氧化钠和二氧化碳反应生成氧气,采用的验证方法是:用一根带火星的木条放在尖嘴管口,若发现木条复燃,则说明反应生成了氧气;
③过氧化钠和二氧化碳反应生成碳酸钠和氧气,化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。

 名校课堂系列答案
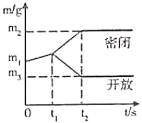
名校课堂系列答案【题目】在一密闭容器中,物质X不完全燃烧时可以产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,正确的是
物质 | X | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. X中碳元素的质量分数为52.2% B. X中只含有C、H两种元素
C. 表中a的值为3.4 D. 无法确定X中是否含有氧元素
【题目】水是生命之源,人类的生产、生活都离不开水。
(1)自然界中的水含有许多可溶性和不溶性杂质。长期饮用硬水可能会引起体内结石,生活中常用____________的方法来降低水的硬度。
(2)水是常用的溶剂,配制下列溶液时,以水做溶剂的是_______(填序号)。
A.生理盐水 B.医用碘酒 C.高锰酸钾溶液 D.医用酒精
(3)下表是NaCl、KNO3在不同温度时的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①根据表中的数据,在坐标纸上绘制出氯化钠和硝酸钾两种物质的溶解度曲线。(请用铅笔在答题卡的坐标纸上绘图)________
②根据绘制的氯化钠和硝酸钾的溶解度曲线判断,温度大约在_____℃时,两种物质的溶解度大小相等。
③现有氯化钠和硝酸钾各40g ,30℃时,分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是______(填溶质名称), 将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的方法是_____。
④在60℃时,硝酸钾的溶解度是110g。这句话的含义是______。
(4)以太阳能为热源,经由铁氧化合物循环分解水的过程如右图所示:
① 写出在一定条件下发生的反应Ⅱ的化学方程式______。
② 在上述循环过程中,最终得到的产品是________。
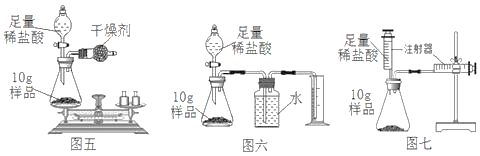
【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
(1)写出该反应的化学方程式。
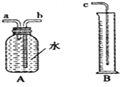
(2)图中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____(a或b)管接c。
(3)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过_________来体现反应快慢的。
(4)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:______________。
(5)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。