题目内容
【题目】如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
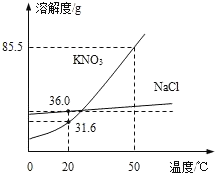
(1)20℃时,KNO3的溶解度是_____g,以下实验中:
10mL水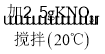 x
x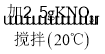 y
y![]() z
z
x、y、z中为饱和溶液的是_____.
(2)若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是_____.
(3)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、_____、_____,然后过滤、洗涤、干燥.
【答案】31.6 y 加入溶质或蒸发溶剂 升高温度 冷却热饱和溶液
【解析】
(1)据图可以看出,20℃时,KNO3的溶解度是31.6g,故10mL水中最多溶解3.16g硝酸钾,在10mL水中加入2.5g硝酸钾能全部溶解,形成的是不饱和溶液;再加2.5g则溶解不了,形成的y溶液是饱和溶液,在50℃时硝酸钾的溶解度是85.5g,故加入的5g硝酸钾全部溶解,形成的z溶液是不饱和溶液,故填:31.6;y;
(2)使NaCl溶液由不饱和变为饱和溶液,一般采用加入溶质或蒸发水分的方法,故填:加入溶质或蒸发溶剂;
(3)硝酸钾的溶解度随温度的升高而增大明显,故要析出硝酸钾的晶体可以使用降温结晶的方法,故需要先配成热的饱和溶液,再降低温度,故填:升高温度,冷却热饱和溶液.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程。
(1)小华同学取10 g黄铜,加入足量的稀硫酸,共收集到气体0.2 g,则黄铜中铜的质量分数是多少__________?(写出计算过程)
(2)小婷同学另取10 g黄铜于烧杯中,将120 g稀硫酸分六次加入烧杯中,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表,表中m=___________。
次数 | 一 | 二 | 三 | 四 | 五 | 六 |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量/g | 29.96 | 49.92 | m | 89.84 | 109.8 | 129.8 |
【题目】实验一:如图是实验室制取气体常用的装置,回答问题:
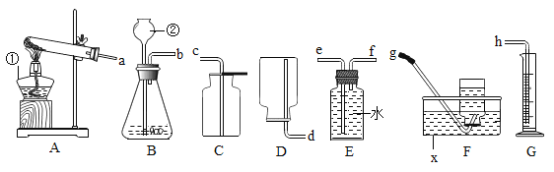
(1)写出标号仪器的名称:①___________________、②_______________________;
(2)若实验室要用同一装置制取并收集O2和CO2,最好选择____________装置组合(填标号),写出用该装置制取O2的化学方程式____________________________________________________________。
(3)实验室用锌与稀硫酸反应来制取氢气并测定氢气的体积,请从图中选择最佳的装置进行组合,整套装置的导管口连接顺序是________(填标号)
Aa→d Bb→g Cb→e→f→h Db→f→e→h
(4)氨气(NH3)是一种无色有刺激性气味的气体,密度比空气小,极易溶于水,实验室常用加热氯化铵和氢氧化钙的固体混合物制取氨气。可选用如图中____________(填标号)装置组合制取并收集氨气。若用如图装置收集,氨气应从________(填“a”或“b”)导管口进入。
实验二:某同学将光亮的镁条放入NaHCO3饱和溶液中,镁条消失并产生大量气泡和白色固体。为确定产生的气体和白色固体的成分,该同学进行了如下的探究。
(查阅资料)①Mg(HCO3)2能溶于水;
②MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
③碱石灰主要成分是NaOH和CaO的混合物。
(猜想假设)①白色固体可能是Mg(OH)2;
②白色固体可能是MgCO3;
③白色固体可能是__________________。
(进行实验)
(1)收集并点燃产生的气体,火焰呈淡蓝色,火焰上方罩涂有澄清石灰水的小烧杯,无明显现象,则该气体为_________。
(2)对白色固体进行实验:
实验步骤 | 现象 | 结论 |
①取洗净后的白色固体,加入足量的________ | 观察到______ | 白色固体一定含有MgCO3 |
②取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 | 碱石灰增重,浓硫酸不变 | 白色固体一定含有_______,可能含有___。 |
(反思评价)为进一步确定可能含有的物质,对实验②如何改进,写出具体的操作方法和结论_______________。