��Ŀ����
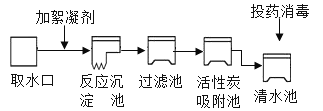
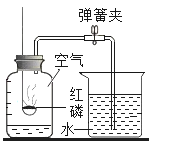
����Ŀ����嫵Ĵ����̲��ŷḻ����Դ��������ˮ��Դǰ��������̽��ѧϰС���Ժ���Ca2+��Mg2+��Cl�����ӵ�±ˮ�ͱ��ǣ���Ҫ�ɷ�ΪCaCO3��Ϊ��Ҫԭ����ʵ�����Ʊ���ˮCaCl2��������ͼ1����ش��������⣺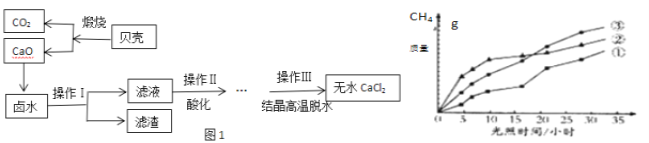
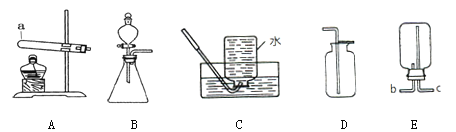
��1�����������õ��IJ����������ձ���©���������������в�������������_______��
��2����MgCl2Ϊ��д��±ˮ�г�ȥMg2+ʱ������Ӧ�Ļ�ѧ����ʽ_________________��
��3���������ữʱӦѡ�������______________����д��ѧʽ����
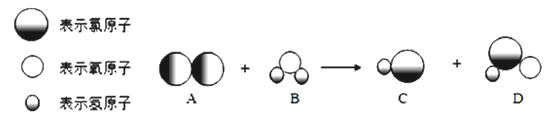
��4�����յ�CO2������������ʹ�������������ˮ������Ӧ������CH4��O2���÷�Ӧ�Ļ�ѧ����ʽΪ____������������ʱ���ڲ�ͬ�������١��ڡ��ۣ��������£�CH4���������ʱ��ı仯��ͼ��ʾ���ڵ�10СʱʱCH4���������________����д���١������ڡ����ۡ�����
��5����֪T��ʱ���ֻ�������ˮ�к�Һ���е��ܽ�����±���
AgNO3 | Ba��NO3��2 | AgCl | BaCl2 | |
H2O��1�� | 170g | 92.0g | 1.50��10��4g | 33.3g |
NH3��1�� | 86.0g | 97.2g | 0.80g | 0.00g |
����������������Һ���з������ֽⷴӦ�Ļ�ѧ����ʽΪ__________________��
���𰸡�����MgCl2+Ca��OH��2=CaCl2+Mg��OH��2��HClCO2+2H2O![]() CH4+2O2����Ba��NO3��2+2AgCl�T2AgNO3+BaCl2��
CH4+2O2����Ba��NO3��2+2AgCl�T2AgNO3+BaCl2��
��������
��1������ʱ��������������������ֹҺ���⽦��������Ϊ������
��2��þ���ӿ������������ӷ�Ӧ���ɰ�ɫ������þ��ɫ�����������ղ���Ϊ��ˮ�Ȼ��ƣ���ѡ������������Һ��ȥþ���ӣ���Ӧ��ѧ����ʽΪMgCl2+Ca��OH��2=CaCl2+Mg��OH��2����
��3�������ղ���Ϊ��ˮ�Ȼ������ʲ������������������ʣ���ѡ��ϡ������в��������ữ���仯ѧʽΪHCl��
��4�����������������д��������ʻ�ѧʽ�Լ���Ӧ�������ٽ�����ƽ���ɣ��ʻ�ѧ����ʽΪCO2+2H2O![]() CH4+2O2����ͼ�������֪����ʮСʱ��ʱ������CH4������ߣ�
CH4+2O2����ͼ�������֪����ʮСʱ��ʱ������CH4������ߣ�
��5����Һ���У��Ȼ������������ݸ��ֽⷴӦ������������֪�����������ʲ�������ˮ�����壬����Ҫ�������ֽⷴӦ���������ɳ����ſ��Է�����ͨ���۲췢�֣����ᱵ���Ȼ������������Ȼ����������ʷ���ʽΪBa(NO3)2+2AgCl�T2AgNO3+BaCl2����