题目内容
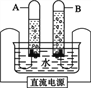
【题目】通过实验测定空气中氧气的含量,如图所示:
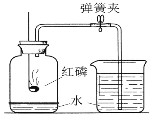
(1)写出红磷燃烧的符号表达式:______。
(2)实验中红磷要足量,目的是:______。
(3)集气瓶事先放少量水,目的是:______。
(4)冷却后,打开止水夹,观察到的现象是:______。
【答案】P+O2 ![]() P2O5 耗尽O2吸收热量使装置迅速恢复至室温,吸收白烟水被吸入集气瓶中,约占原瓶空气体积的1/5
P2O5 耗尽O2吸收热量使装置迅速恢复至室温,吸收白烟水被吸入集气瓶中,约占原瓶空气体积的1/5
【解析】
本题考查了测定空气中氧气的含量的实验。根据实验原理,实验操作要点进行分析。
(1)红磷燃烧生成五氧化二磷,反应的符号表达式:P+O2 ![]() P2O5;
P2O5;
(2)若要准确测定空气中氧气的含量,必须将容器内有氧气完全消耗。实验中红磷要足量,目的是:耗尽氧气(O2);
(3)由于红磷燃烧生成了五氧化二磷,并放出了大量的热,所以,集气瓶内事先装水的目的:吸收热量使装置迅速恢复至室温,吸收白烟;
(4)磷燃烧消耗氧气使瓶内压强减小,在外界大气压的作用下水沿着导管被压入集气瓶内,进入水的等于体积消耗的氧气体积。所以冷却后,打开止水夹,观察到的现象是:水被吸入集气瓶中,约占原瓶空气体积的1/5。

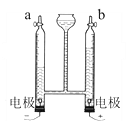
【题目】“分解”与“化合”是两种研究物质组成的方法。
研究问题 | 探究水的元素组成 | 探究氧化汞的元素组成 |
研究方法 | 水的分解 | 汞与氧气的化合 |
搜集证据 |
用燃着的木条检验a端气体,气体燃烧发出________色火焰,发生反应的化学方程式为________;用带火星的木条检验b端气体,观察到________。 | 汞与氧气化合的微观过程示意图
请将上图中反应后缺少的微粒补画完整________。 |
结论 | 水是由________元素组成的。 | 氧化汞是由氧、汞元素组成的。 |
【题目】浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔,探究学习小组以含有Ca2+,Mg2+,Cl﹣离子的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1:请回答下列问题: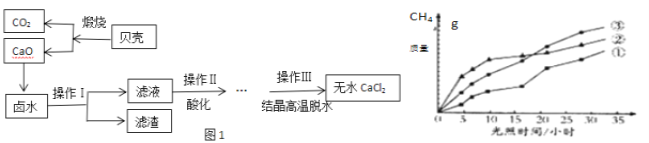
(1)操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒,其中玻璃棒的作用是_______。
(2)以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式_________________。
(3)操作Ⅱ酸化时应选择的酸是______________(填写化学式)。
(4)回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成CH4和O2,该反应的化学方程式为____,紫外线照射时,在不同催化剂(①、②、③)的作用下,CH4产量随光照时间的变化如图所示,在第10小时时CH4产量最高是________(填写“①”、“②”、或“③”).
(5)已知T℃时四种化合物在水中和液氨中的溶解度如下表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O(1) | 170g | 92.0g | 1.50×10﹣4g | 33.3g |
NH3(1) | 86.0g | 97.2g | 0.80g | 0.00g |
上述四种物质能在液氨中发生复分解反应的化学方程式为__________________。